Tag: 免疫系統
戰鎚《荷魯斯叛亂》聖血天使 多米尼恩·澤豐
價格:18英鎊
廠商:Games Workshop
發售日:2022/2/19
戰鎚遊戲製作公司Games Workshop(以下簡稱GW),專門生產高細節塑料模型。GW所經營的戰鎚系列遊戲分別分為 戰鎚40K(科幻) 戰鎚西格瑪時代(奇幻) 魔戒(奇幻) 其風格多為 歐美黑暗哥特風格 和 歐美蒸汽朋克 風格。
本次GW為了慶祝《荷魯斯叛亂》系列小說《泰拉圍城》的熱銷,特意將兩個小說中的人物進行了開模。本貼介紹的是聖血天使的「多米尼恩·澤豐」。澤恩在聖血天使中是一名受人尊敬的連長,但是他在一次與異性的戰鬥中身負重傷,在治療的過程中發現澤恩連長有星際戰士少見免疫系統排異疾病使得他不能正常使用機械義肢(手抖的不能拿槍)。後來澤恩連長在泰拉執行外交任務被著名考古學家」阿坎蘭德 「使用特殊技術治癒了他的免疫系統排異疾病,使得他重新加入保衛泰拉的戰鬥。
多米尼恩·澤豐
細節圖
板件圖
包裝圖
來源:78動漫
COVID的「超級免疫力」:這場大流行的巨大謎團之一
大約一年前--在Delta和其他變體成為COVID-19主導毒株之前--美國洛克菲勒大學的病毒學家Theodora Hatziioannou和Paul Bieniasz著手製作一個關鍵SARS-CoV-2蛋白的版本,該蛋白有能力躲避我們身體製造的所有感染阻斷抗體。研究人員的目標是確定SARS-CoV-2用於感染細胞的蛋白--被這些中和抗體鎖定的部分,以便繪制我們身體對病毒攻擊的關鍵部分。 因此,研究人員混合和匹配了在實驗室實驗和流通病毒中發現的可能涉及的突變,並在不能引起COVID-19的無害"假型"病毒中測試了他們的Franken刺突蛋白。在今年9月發表在《自然》雜誌上的一項研究中,他們報告說,含有20個變化的刺突蛋白變體對大多數被感染或接種過疫苗的人所產生的中和抗體具有完全的抵抗力--但並非對每個人都如此。
那些在接受疫苗接種前幾個月就已經從COVID-19中恢復過來的人體內含有能夠抵抗突變刺突蛋白的抗體,其對免疫攻擊的抵抗力遠遠超過任何已知的自然發生的變體。這些人的抗體甚至能阻止其他類型的冠狀病毒。Hatziioannou說:「它們很可能對未來 SARS-CoV-2 對它們產生的任何變體都有效。」
當全世界都在關注新的冠狀病毒變體時,這種"超級免疫力"的基礎已經成為該大流行病的一個巨大謎團。研究人員希望,通過繪制來自感染的免疫保護與來自疫苗接種的免疫保護之間的差異,他們可以為這種更高水平的保護制定一條更安全的道路。
埃默里大學的病毒學家Mehul Suthar說:"這對加強劑以及我們的免疫反應如何為出現的下一個變體做好准備都有影響。我們正在努力解決這個問題。"
「混合免疫力」
在各國開始推出疫苗後不久,研究人員開始注意到以前感染過COVID-19並康復的人的疫苗反應的獨特性質。研究超級免疫力團隊的成員、賓夕法尼亞大學的免疫學家Rishi Goel說:「我們看到,這些抗體達到了天文數字的水平,超過了你從兩劑疫苗中獲得的抗體。」
對具有混合免疫力的人進行的初步研究發現,與從未遇到過SARS-CoV-22的疫苗接種者相比,他們的血清--血液中含有的抗體部分--能夠更好地中和逃避免疫的毒株,例如在南非發現的Beta變體,以及其他冠狀病毒。目前還不清楚這僅僅是由於高水平的中和抗體,還是由於其他特性。
最近的研究表明,混合免疫力至少有一部分是由於被稱為記憶B細胞的免疫「參與者」。感染或接種疫苗後產生的大部分抗體來自稱為質粒細胞的短壽命細胞,當這些細胞不可避免地死亡時,抗體水平會下降。一旦漿細胞消失,抗體的主要來源就變成了更罕見的記憶B細胞,這些細胞由感染或疫苗接種觸發。
洛克菲勒大學的免疫學家Michel Nussenzweig說,這些長壽細胞中的一些會產生比質粒細胞更高質量的抗體。這是因為它們在被稱為淋巴結的器官中進化,獲得突變,幫助它們隨著時間的推移更緊密地與刺突蛋白結合。當從COVID-19中恢復過來的人再次接觸到SARS-CoV-2的刺突蛋白時,這些細胞會繁殖並產生更多的這種高度有效的抗體。
強大的抗體
由感染引發的記憶B細胞和由疫苗接種引發的記憶B細胞之間的差異--以及它們產生的抗體--也可能是混合免疫的高度反應的基礎。Nussenzweig說,感染和疫苗接種以截然不同的方式向免疫系統暴露刺突蛋白。
在一系列的研究中,Nussenzweig的團隊(包括Hatziioannou和Bieniasz等人)比較了感染者和疫苗接種者的抗體反應。兩者都會導致記憶B細胞的建立,這些細胞製造的抗體經過進化後變得更加有力,但研究人員認為這在感染後發生的程度更高。
研究小組在感染和接種疫苗後的不同時間點,從人們身上分離出了數百個記憶B細胞--每個都製造一種獨特的抗體。自然感染引發的抗體在感染後一年內繼續增加其效力和針對變種的廣度,而由疫苗接種引發的大多數抗體似乎在第二劑量後的幾周內停止變化。感染後進化的記憶B細胞也比接種疫苗的記憶B細胞更有可能產生抗體,阻斷諸如Beta和Delta等免疫破壞性變體。
一項單獨的研究發現,與mRNA疫苗接種相比,感染會導致一個抗體「池」,通過針對spike6的不同區域更均勻地識別變體。研究人員還發現,與從未接種過疫苗的人相比,具有混合免疫力的人產生的抗體水平持續較高,時間長達7個月。由麻薩諸塞州波士頓哈佛醫學院的免疫學家Duane Wesemann領導的團隊報告說,具有混合免疫力的人的抗體水平也更加穩定。
研究人員說,許多關於混合免疫力的研究沒有像那些從COVID中恢復過來的人那樣對疫苗接受者進行長時間的跟蹤,他們的B細胞有可能在更多的時間、更多的疫苗劑量或兩者的作用下產生抗體,從而獲得效力和廣度。一個穩定的記憶B細胞庫可能需要幾個月的時間來建立和成熟。
聖路易斯華盛頓大學的B細胞免疫學家Ali Ellebedy說:「被感染和接種疫苗的人得到了很好的反應,這並不奇怪。我們正在將三到四個月前開始比賽的人與現在開始比賽的人進行比較。」
Ellebedy的團隊收集了mRNA疫苗接種者的淋巴結樣本,發現有跡象表明,他們的一些由疫苗接種引發的記憶B細胞在第二次接種後的12周內獲得了突變,使他們能夠識別各種冠狀病毒,包括一些導致普通感冒的病毒7。
Goel、賓夕法尼亞大學的免疫學家John Wherry和他們的同事發現,有跡象表明,在接種疫苗6個月後,來自個體的記憶B細胞在數量上繼續增長,並進化出更大的能力來中和變異體。疫苗接種後,抗體水平下降,但如果這些細胞再次遇到SARS-CoV-2,它們應該開始產生抗體。"現實情況是,你有一個高質量的記憶B細胞池,如果你再次見到這種抗原,它就會在那里保護你,"Goel說。
加強針的好處
巴黎內克爾病童研究所的免疫學家Matthieu Mahévas說,第三劑疫苗可能會讓沒有被感染的人獲得混合免疫的好處。他的團隊發現,在接種疫苗兩個月後,一些來自天真的疫苗接受者的記憶B細胞可以識別Beta和Delta。Mahévas說:「當你提升這個池子時,你可以清楚地想像你將產生針對變體的有效中和抗體。」
延長疫苗劑量之間的間隔也可以模仿混合免疫的各個方面。2021年,在疫苗供應匱乏和病例激增的情況下,加拿大魁北克省的官員建議第一和第二劑疫苗的間隔時間為16周(後來減少到8周)。
由加拿大蒙特婁大學的病毒學家Andrés Finzi共同領導的一個小組發現,接受這種方案的人的SARS-CoV-2抗體水平與具有混合免疫力的人相似。這些抗體可以中和大量的SARS-CoV-2變種--以及2002-4年SARS疫情背後的病毒。Finzi說:「我們能夠使從未感染病毒的人達到與以前的感染者和疫苗接種者幾乎相同的水平,這是我們的黃金標準。」
科學家們說,了解混合免疫背後的機制將是模仿它的關鍵。最新研究的重點是B細胞產生的抗體反應,而T細胞對疫苗接種和感染的反應很可能表現不同。自然感染還引發了針對病毒蛋白的反應。Nussenzweig想知道自然感染的其他獨特因素是否至關重要。在感染過程中,數以億計的病毒顆粒充斥著呼吸道,遇到了「定期訪問」附近淋巴結的免疫細胞,那里的記憶B細胞成熟。病毒蛋白在一些人的腸道中停留了幾個月後才恢復,這種持續存在可能有助於B細胞磨練對SARS-CoV-2的反應。
研究人員說,確定混合免疫的現實世界的影響也很重要。來自卡達的一項研究表明,與沒有感染史的人相比,感染後接種輝瑞-BioNTech公司的mRNA疫苗的人對COVID-19檢測呈陽性的可能性較小。里約熱內盧Oswaldo Cruz研究所的病毒學家Gonzalo Bello Bentancor說,混合免疫力也可能是整個南美洲病例數量下降的原因。許多南美國家在這一流行病的早期經歷了非常高的感染率,但現在已經為其人口中的很大一部分人接種了疫苗。Bello Bentancor 說,在阻斷傳播方面,混合免疫力有可能比單獨接種疫苗的免疫效果更好。
隨著Delta變體引起的突破性感染的增多,包括Nussenzweig在內的研究人員熱衷於研究那些在接種COVID-19疫苗後而不是之前被感染的人的免疫力。一個人第一次接觸流感病毒會使他們對隨後的接觸和疫苗接種的反應產生偏差--這種現象被稱為「抗原原罪」--研究人員想知道SARS-CoV-2是否發生這種情況。
那些研究混合免疫的人強調,不管有什麼潛在的好處,SARS-CoV-2感染的風險意味著應該避免它。
來源:cnBeta
難怪按摩這麼舒服:哈佛科學家首次揭示按摩促進肌肉修復的原理
腰酸背痛的時候,按摩讓人感覺得到了「治癒」。很多運動員還會在訓練後讓理療師按摩或使用筋膜槍等工具來放鬆肌肉。盡管按摩是種傳統而常用的康復手段,但按摩為什麼有效,最近剛剛獲得了科學的解釋。 ...
人體免疫系統能「記住」新冠病毒一年以上
抵禦新冠病毒的攻擊後,我們體內的免疫系統能不能「記住」?如果能,感染一次新冠是不是有機會終身免疫。如果不能,那麼應該在多久後加強免疫……新冠病毒感染後人體的免疫記憶問題,始終是應對疫情的焦點。
紐西蘭宣布放棄徹底消除新冠戰略 尋求「與病毒共存」
◎ 科技日報記者 張佳星
10月5日,中國疾控中心病毒病所劉軍研究員聯合高福院士、武桂珍研究員團隊在權威期刊《臨床傳染病》(Clinical Infectious Diseases)上發表研究顯示,人體對新冠病毒的免疫記憶能夠維持一年以上,感染後一年仍具有新冠特異性中和抗體和T細胞免疫記憶的康復者比例分別為95%和92%。
「我們對101名新冠肺炎康復者進行了半年和一年的回訪,通過血清樣本的多項檢測,包括對活病毒的中和反應,以及免疫記憶T細胞的病毒特異性檢測,來探測免疫抗體和免疫記憶T細胞是否還存在。」10月7日,論文通訊作者之一、中國疾控中心病毒病預防控制所研究員劉軍告訴科技日報記者。
「追尋」免疫記憶
免疫記憶究竟如何追尋?
如果想知道一個人有沒有記憶,只需問:記住了嗎?
「想知道免疫系統在新冠感染有沒有記憶,是要找到有沒有相關的T細胞和B細胞。」劉軍介紹, T細胞及B細胞等獲得性免疫因素是免疫記憶的關鍵。
新冠康復者免疫記憶隨訪研究流程圖
因此,研究工作要「釣」出免疫記憶相關的細胞,就得先製造特別的、能與新冠病毒相關的記憶細胞匹配的「記憶片段」作為「餌」。
這個「記憶片段」就是新冠病毒蛋白質的「小片段」多肽,它們將引起在新冠肺炎康復者的血細胞中的T細胞的「記憶回閃」,再次激發免疫反應,最終通過顯色反應發現。
因此,「餌」的設計至關重要,它即要有特異性,又要有靈敏性。
這就好比在一部影視庫里尋找《長津湖》最打動你的片段,抗美援朝的相同題材很多,如何用最特異、又不超過1分鍾的影視片段作為檢索詞,就能鎖定想找到的劇情呢?
針對新冠病毒顆粒上的S蛋白、M蛋白和N蛋白,團隊分別設計了針對S1、S2、M和N蛋白的特異性肽池,「圍獵」免疫記憶細胞的「獵捕」。
為了提高特異性,研究團隊還專門合成了針對新冠特異性肽的四聚體復合物,對免疫記憶T細胞進行「立體」搜索。
一年內,免疫記憶竟沒有「消退」跡象
在對101名康復者的血細胞進行全方位、立體式的記憶細胞搜尋後,研究團隊發現,93%的康復者在發病後6個月存在新冠病毒特異性T細胞免疫記憶,這種特異性T細胞免疫記憶在92%的康復者中可持續至發病後12個月。
「我們發現,發病後12個月與6個月相比,康復者的病毒特異性記憶T細胞百分比並沒有顯著下降。」劉軍說,這意味著,免疫記憶仍將持續。
免疫記憶細胞有不同的種類,團隊還對中樞記憶性T細胞和效應記憶性T細胞做了分類尋找,結果表明後者占多數。
「這意味著針對病毒特異的T細胞免疫記憶依然存在,可用於抵禦再次感染。」劉軍說。
而更有意思的是,T細胞免疫應答水平與疾病嚴重程度呈正相關。也就是說,康復者在感染時症狀越嚴重,免疫記憶「越深刻」。
與此同時,針對S蛋白的T細胞記憶水平與新冠病毒特異性抗體水平呈正相關,即抗體水平越高,T細胞免疫記憶越顯著。說明人體針對新冠的兩道記憶「防線」是相輔相成的。
一年後,特異性抗體持續存在
研究者同時對特異性抗體進行了檢測,並進行了規律分析。
研究顯示,95%以上的康復者中,特異性IgG抗體和中和抗體可在發病後6個月至12個月持續存在,其滴度與急性期的嚴重程度成正相關。在發病後6個月及12個月時,中和抗體也沒有明顯消退跡象。
「特異性的T細胞免疫記憶和抗體能持續至少一年以上,這對個體避免再次感染新冠病毒起到非常積極的作用。」劉軍表示,免疫記憶特徵的研究和相關機理的完善也會為疫苗策略的制定提供理論依據。
「我們還發現至少有26%康復者在發病後12個月仍能檢測到IgM抗體,推測IgM在部分康復者中的長期持續存在可能是COVID-19的感染免疫特徵之一,其機制有待進一步研究。」劉軍說。
據介紹,該項研究得到了科技部科技重大專項和國家自然科學基金(優秀青年科學基金和創新研究群體項目)等項目的資助。
來源:cnBeta
“逆向疫苗”訓練免疫系統不攻擊有益的藥物
免疫系統是保護我們免受危險感染的強大武器,但有時它也會有點過度熱情,攻擊那些試圖幫助我們的東西。一種新的臨床前治療方法有朝一日可以提供幫助,它使用一種"反向疫苗"來訓練免疫系統,使其忽略特定的藥物或分子。
盡管免疫系統具有保護能力,但它可能錯誤地攻擊藥物、食物或環境中的無害分子、蛋白質或酶,導致過敏或降低治療效果。其他時候,它可以開始攻擊我們體內的細胞,引發廣泛的自身免疫性疾病。
因此,如果疫苗接種是通過加強免疫系統對特定目標的反應來發揮作用,那麼這個過程是否可以"逆轉",以建立對有益事物的耐受性?在這項新的研究中,水牛城大學的研究人員就這樣做了調查。
該團隊專注於兩種特定的疾病,這些疾病的治療往往受到免疫系統的阻撓。血友病A是一種血凝塊不能正常形成的疾病,治療涉及被稱為第八因子的凝血劑--免疫系統可使其失去活性。同時,龐貝病是一種罕見的遺傳性疾病,由於一種叫做GAA的酶的數量不足而使肌肉變弱。酶替代療法可以提供幫助--除非免疫系統攻擊這些酶,而在幾乎所有的病例中它都會攻擊這些酶。
然而,幾種拯救生命的治療藥物的安全性和有效性會受到抗藥物抗體的影響。一旦產生抗體,患者可用的臨床選擇就會變得昂貴,而且在一些情況下是無效的。
以前的研究表明,一種叫做Lyso-PS的脂肪酸可以提供幫助。當與治療性蛋白質一起給藥時,脂肪酸似乎可以幫助免疫系統耐受藥物。在新的研究中,布法羅團隊開發了一種Lyso-PS納米粒子,其大小和特性恰到好處,容易被細胞所吸收。
該團隊在血友病和龐貝病的小鼠模型中測試了這種組合,將納米粒子與通常的治療性蛋白質一起給動物服用。果然,納米粒子成功地阻止了75%的血友病小鼠產生針對第八因子蛋白的抗體,而大多數龐貝病小鼠的抗GAA抗體水平也明顯降低。這兩種治療方法在靜脈注射或口服時效果都很好。
研究人員說,這種治療方法不僅可以對測試的兩種疾病有效,而且最終可以擴展到過敏、自身免疫性疾病和其他藥物治療。
該研究的第一作者Nhan Hanh Nguyen說:"與其試圖逆轉抗藥性抗體,這具有很大的挑戰性,不如防止抗體發展的臨床治療可能是一個更有效的策略。我們的方法是基於這樣的原理:在有Lyso-PS的情況下預先接觸一種蛋白質,教導免疫系統不要發起反應"。
該研究發表在《科學報告》雜誌上。
來源:cnBeta
研究發現高脂肪飲食幫助癌細胞「躲避」免疫系統
據媒體報導,到目前為止,高脂肪飲食被認為與患結腸癌的風險增加有關,這一點已經得到確認,但這兩者是如何關聯仍然不清楚。麻省理工學院、哈佛醫學院和冷泉港實驗室的研究人員的一項新研究改變了這一點。至少當涉及到小鼠時,高脂肪飲食被發現幫助癌細胞「躲避」免疫系統。
免疫細胞監測身體是否有需要被摧毀的異常細胞,幫助防止各種疾病和其他健康問題的發展。一些免疫細胞通過尋找細胞上所謂的「標簽」來工作,這些「標簽」幫助它們分辨一個細胞是正常健康還是不正常。
在腸道細胞的案例中,該研究發現高脂肪飲食抑制了名為MHC-II的「標簽」,它觸發了免疫細胞在成為一個大問題之前摧毀舊的或潛在的癌前細胞。由高脂肪飲食引起的帶有被抑制的「標簽」的異常細胞可能會逃避免疫系統的檢測,有可能使它們繼續存在並成長為癌性腫瘤。
此外,該研究發現,攝入高脂肪飲食也會引起腸道細菌的變化,增加可增加MHC-II「標簽」的細菌水平。這種變化可能有助於免疫系統找到並摧毀異常細胞。這一發現可能為未來的癌症治療鋪平道路,除其他外,改變身體的微生物組以幫助清除癌細胞。
這是詳細說明飲食結構如何對身體及其功能產生巨大影響的最新研究。例如,最近的一項研究詳細說明了果糖如何以促進體重增加和肥胖的方式改變腸道細胞。飲食同樣影響著腸道細菌,而腸道細菌在促進健康方面也發揮著很大作用。
來源:cnBeta
研究人員將噬菌體與抗生素結合起來以對抗嚴重疾病
研究人員利用噬菌體發現了一種新的潛在治療抗生素抗性細菌的方法。科學家們目前正在測試新的治療方案,利用一種噬菌體與目前用於治療通常對抗生素有抗性的感染的抗生素相結合。在過去的研究中,該團隊在一萬個噬菌體中確定了一個名為Muddy的噬菌體,已知它能在培養皿中有效地殺死細菌。
該噬菌體被確定為治療人類感染的候選者。該團隊著手通過使用攜帶導致人類囊性纖維化的基因突變的斑馬魚來測試他們的新治療方式對人類的潛在有效性。斑馬魚可以用來模擬人類免疫系統對細菌感染的反應方式。
該團隊使用從一名囊性纖維化患者那里獲得的抗生素耐藥型膿腫分枝桿菌(一種對人類肺部具有高度破壞性並經常對抗生素產生抗藥性的細菌的膿腫分枝桿菌)來感染斑馬魚並測試新療法。感染魚後,研究小組對它們進行了12天的監測,發現它們出現了嚴重的感染與膿腫,並大量死亡,只有20%的魚存活。然後,研究小組測試了被感染的魚在注射了"Muddy"後的恢復情況。
研究小組發現,用"Muddy"治療五天後,魚的嚴重感染程度降低,存活率明顯提高,達到40%。在嚴重感染期間,接受治療的魚的膿腫也較少。研究小組隨後將瑪迪與抗生素配對,存活率攀升至70%,膿腫也大大減少。
當然你這一研究還需要做更多的工作,包括進行臨床試驗,以確定該噬菌體療法對人類是否有效。
來源:cnBeta
研究稱可通過低劑量輻射來加熱「冷」腫瘤 使靶向治療變得更容易
據媒體報導,導致不同的癌症治療方法沒有達到預期效的原因有很多,盡管人們做出了最大的努力,但疾病仍然能夠發展。其中一個例子是幾乎不含任何免疫細胞的腫瘤,這使得免疫療法癌症治療在很大程度上具有感染性。一項新研究表明,這些已經「變冷」的腫瘤如何能夠通過精心管理的輻射劑量而被加熱,吸引新的免疫細胞,從而從內部進行「戰鬥」。 ...
免疫細胞協同合作捕食細菌
就像蜘蛛捕捉獵物一樣,我們的免疫細胞也會協同合作,捕捉並「吃掉」細菌。據11日發表在《科學進展》雜誌上的一項研究,美國范德堡大學醫學中心研究人員發現了免疫細胞的抗菌新機制,有助於開發對抗金黃色葡萄球菌和其他病原體的新策略。 ...
光和氧的力量可清除活體小鼠大腦中的阿爾茨海默病蛋白
最近在小鼠身上測試的一種小型光激活分子代表了一種消除阿爾茨海默病患者大腦中發現的澱粉樣蛋白團塊的新方法。如果在人類身上得到完善,該技術可以作為免疫療法的替代方法,並用於治療由類似澱粉樣蛋白引起的其他疾病。
研究人員將該分子直接注射到患有阿爾茨海默病的活體小鼠的大腦中,然後用一個專門的探針每天向其大腦照射30分鍾,持續一周。對小鼠大腦組織的化學分析顯示,該治療方法明顯減少了澱粉樣蛋白。使用阿爾茨海默病患者捐贈的人腦樣本進行的額外實驗結果支持了未來在人類身上使用的可能性。
東京大學講師、最近發表在《大腦》雜誌上的研究的共同第一作者Yukiko Hori說:"我們研究的重要性在於開發這種技術,以澱粉樣蛋白為目標,加強免疫系統對它的清除。"
該研究小組開發的小分子被稱為光氧催化劑。它似乎通過一個兩步過程來治療阿爾茨海默病。首先,該催化劑破壞了澱粉樣斑塊的穩定性。氧化,或添加氧原子,可以通過改變固定分子的化學鍵使其不穩定。被稱為"氧漂白劑"的洗衣粉或其他清潔劑使用類似的化學原理。
該催化劑被設計為針對澱粉樣蛋白的折疊結構,並可能通過交聯被稱為組氨酸殘基的特定部分來發揮作用。催化劑在被近紅外光激活之前是惰性的,因此在未來,研究人員設想這種催化劑可以通過注射到血液中被輸送到整個身體,並通過光瞄準特定區域。
其次,不穩定的澱粉樣蛋白隨後被小膠質細胞清除,小膠質細胞是大腦的免疫細胞,負責清除健康細胞外的受損細胞和碎片。研究人員利用在培養皿中生長的小鼠細胞,觀察到小膠質細胞吞噬含氧澱粉樣蛋白,然後在細胞內的酸性隔間內將其分解。
東京大學領導該項目的富田泰介教授說:"我們的催化劑與澱粉樣蛋白的特定結構結合,而不是與獨特的基因或胺基酸序列結合,因此這種相同的催化劑可以應用於其他澱粉樣蛋白的沉積。"
美國臨床腫瘤學會估計,在美國,每年有4000人被診斷出患有由腦外澱粉樣蛋白引起的疾病,統稱為澱粉樣蛋白病。光氧催化劑應該能夠去除澱粉樣蛋白,無論它在何時何地在體內形成。盡管一些現有的阿爾茨海默病治療方法可以減緩新的澱粉樣斑塊的形成,但消除現有的斑塊對阿爾茨海默病尤其重要,因為澱粉樣蛋白在症狀出現前幾年就開始聚集了。
研究小組現在正在努力修改催化劑的設計,使其能夠通過照射頭骨來激活。
來源:cnBeta
牛津大學癌症疫苗/免疫療法組合即將展開人體試驗
據媒體報導,牛津大學的科學家們展示了一種強有力的組合--癌症疫苗和免疫療法。在老鼠身上進行的試驗中,疫苗提高了尋找腫瘤的免疫細胞的水平,而免疫療法則使它們成為更有效的殺手。人體試驗將於今年晚些時候開始。 人體免疫系統是一條強大的防禦前線,在我們的身體上巡邏並防止病毒和細菌等外來入侵者及越界可能癌變的流氓細胞。不幸的是,癌症有許多不為人知的技術來逃避免疫系統的檢測。
免疫療法的目的是讓我們的身體再次占據上風、增強免疫細胞並更好地對抗癌症。其中一種方法是去除阻止免疫細胞過度野生的天然「檢查點」,盡管這項技術在對抗某些癌症方面顯示出了希望,但對其他癌症的結果卻不那麼令人鼓舞。
問題似乎是,讓病人的免疫細胞脫離束縛仍受限於這些免疫細胞的數量,所以提高這些數字是癌症疫苗的目的。
牛津大學研究小組利用跟牛津-阿斯利康新冠病毒疫苗相同的病毒載體開發出了兩劑治療性癌症疫苗。這種疫苗增加了CD8+ T細胞的水平,據悉,CD8+ T細胞是針對MAGE-A3和NY-ESO-1這兩種只出現在癌細胞表面的蛋白質。
這項研究的論文作者之一Benoit Van den Eynde指出:「MAGE蛋白作為疫苗靶點比其他癌症抗原有優勢,因為它們存在於廣泛的腫瘤類型中。這擴大了這種方法對許多不同類型癌症患者的潛在益處。重要的是,MAGE型抗原不存在於正常組織的表面,這降低了免疫系統攻擊健康細胞產生副作用的風險。」
研究人員將這種疫苗跟免疫療法配對並在小鼠身上測試組合。正如所希望的那樣,疫苗增加了CD8+ T細胞的水平,而免疫治療使它們能更積極地靶向腫瘤。跟對照小鼠或單獨免疫治療相比,這兩種技術一起大大減小了腫瘤的大小、提高了小鼠的存活率。實驗組的老鼠有一半在50天的時候還活著,而對照組的老鼠沒有一個能活到30天。
該團隊表示,這種組合可以用於人類--事實上,一項1/2a期臨床試驗將於今年晚些時候開始,在80名非小細胞肺癌患者中進行。
「我們的癌症疫苗引發強大的CD8+ T細胞反應,浸潤腫瘤,在提高免疫檢查點封鎖療法的療效和改善癌症患者的預後方面顯示出巨大的潛力,」該研究的論文合著者Adrian Hill說道。
這項新研究為越來越多的研究提供了進一步的證據,這些研究表明,癌症疫苗和免疫療法的結合可以變得非常強大。
來源:cnBeta
為什麼年齡越老越冷?–因為免疫細胞的背叛
據媒體報導,人類的進化為我們提供了一定程度的保護,使我們能從體內儲存的脂肪中產生熱量從而免受低溫的威脅。然而隨著年齡的增長,人們變得更容易感冒、炎症和代謝問題,這可能會導致許多慢性疾病。 耶魯大學和加州大學舊金山分校(UCSF)的研究人員發現了這一過程中的一個罪魁禍首--脂肪中保護我們免受低溫傷害的免疫細胞。在一項新研究中,他們發現老年老鼠的脂肪組織失去了免疫細胞組2型先天淋巴細胞(ILC2),這是在寒冷環境下恢復體溫的細胞。但他們還發現,刺激衰老小鼠產生新的ILC2細胞實際上會使它們更容易因寒冷而死亡,這對那些尋求簡易治療衰老疾病的人來說是一個警世故事。
「當你年輕時對你有益的東西隨著你年齡的增長可能會對你有害,」這項研究的共同通信作者Vishwa Deep Dixit說道。相關研究報告已發表在今日(當地時間2021年9月1日)的《Cell Metabolism》上。
Dixit和他的前同事、現任加州大學舊金山分校助理教授的Emily Goldberg很好奇為什麼脂肪組織會庇護免疫系統細胞,這些細胞通常集中在鼻腔、肺部和皮膚等經常暴露於病原體的區域。當他們對年老和年輕老鼠的細胞進行基因排序時,他們發現年老的老鼠缺乏ILC2細胞,這種缺陷限制了它們在寒冷條件下燃燒脂肪和提高體溫的能力。
當科學家引入一種能促進衰老小鼠ILC2生成的分子時,免疫系統細胞得到了恢復,但小鼠對低溫的耐受性更差。
Dixit說道:「簡單的假設是,如果我們恢復失去的東西,那麼我們也將恢復正常的生活。但事實並非如此。這種生長因子並沒有使年輕老鼠的健康細胞擴張,反而使老年老鼠脂肪中的壞ILC2細胞增多。」
但當研究人員從年輕老鼠身上取出ILC2細胞並將其移植到年老老鼠身上時,他們發現,年老老鼠的耐寒能力得到了恢復。
Dixit說道:「免疫細胞發揮的作用不僅僅是防禦病原體,還有助於維持生命的正常代謝功能。隨著年齡的增長,免疫系統已經發生了變化,我們需要小心控制它以恢復老年人的健康。」
來源:cnBeta
為了更快地學習,腦細胞會破壞它們的DNA
據媒體報導,面對威脅,大腦必須迅速採取行動,它的神經元建立新的連接以了解什麼可能意味著生與死的區別。但大腦的反應也增加了風險:正如最近一項令人不安的發現顯示的那樣,為了更快地表達學習和記憶基因,腦細胞會在許多關鍵點將DNA斷裂成碎片,然後再重建斷裂的基因組。
資料圖
這一發現不僅提供了對大腦可塑性本質的深入了解。還表明,DNA斷裂可能是正常細胞過程的常規和重要部分--這對科學家如何看待衰老和疾病以及他們如何處理基因組事件產生影響,他們通常認為只是運氣不好。
這一發現令人驚訝的還一個原因是,DNA雙鏈斷裂是一種特別危險的基因損傷,它跟癌症、神經退化和衰老有關。DNA雙鏈斷裂指的是一種螺旋梯的兩個軌道在基因組的同一位置被切斷。由於沒有一個完整的「模板」留下來指導雙鏈的重新連接,所以細胞修復雙鏈斷裂比修復其他類型的DNA損傷更困難。
然而長期以來人們也認識到,DNA斷裂有時也起著建設性作用。當細胞分裂時,雙鏈斷裂允許染色體之間的正常遺傳重組過程。在發展中的免疫系統中,它們使DNA片段重組並產生多種抗體。雙鏈斷裂還跟神經元發育和幫助開啟某些基因有關。盡管如此,這些功能似乎是例外,雙鏈斷裂是偶然和不受歡迎的規則。
但2015年出現了一個轉折點。神經科學家、麻省理工學院皮考爾學習與記憶研究所所長Li-Huei Tsai和她的同事們正在對之前將阿爾茨海默病跟神經元雙鏈斷裂積累聯系起來的研究進行追蹤。令他們驚訝的是,研究人員發現,刺激培養的神經元會觸發它們DNA中的雙鏈斷裂,而這種斷裂迅速增加了與學習和記憶中的突觸活動相關的12個快速反應基因的表達。
雙鏈斷裂似乎對調節基因活動至關重要,而基因活動對神經元的功能至關重要。Tsai和她的論文合作者推測,斷裂實質上釋放了粘在扭曲的DNA片段上的酶,使它們能快速轉錄附近的相關基因。但Tsai表示,這一想法遭到了很多質疑。「人們只是很難想像雙鏈斷裂實際上在生理上是重要的。」
然而,澳大利亞昆士蘭大學的博士後研究員Paul Marshall和他的同事決定繼續研究這一發現。他們於2019年發表的研究成果證實並擴展了Tsai團隊的觀測結果。結果顯示,DNA斷裂引發了兩波增強的基因轉錄,一波是即時的,另一波是幾小時後的。
Marshall和他的同事提出了一個兩步機制來解釋這一現象:當DNA斷裂時,一些酶分子被釋放出來進行轉錄,斷裂的位置也被一個甲基標記,這是一種所謂的表觀遺傳標記。之後,當受損DNA開始修復時,標記被移除--在這個過程中,更多的酶會溢出來,開始第二輪轉錄。
Marshall說道:「雙鏈斷裂不僅是一個觸發器,它還會成為一個標記,而這個標記本身在調節和引導機制到達那個位置方面具有功能。」
從那時起,其他研究也證明了類似的結果。去年發表的一篇文章認為,雙鏈斷裂不僅跟恐懼記憶的形成有關,還與它的回憶有關。
現在,在上個月發表在《PLOS ONE》上的一項研究中,Tsai和她的同事表明,這種違反直覺的基因表達機制可能在大腦中普遍存在。這一次,他們沒有使用培養的神經元,而是觀察了活老鼠大腦中的細胞,這些老鼠正在學習將環境與電擊聯系起來。當研究小組繪制受電擊小鼠的前額皮質和海馬體雙鏈斷裂的基因圖譜時,他們發現近數百個基因發生了斷裂,其中許多與記憶相關的突觸過程有關。
然而同樣有趣的是,沒有受到電擊的老鼠的神經元中也出現了一些雙鏈斷裂。維吉尼亞理工學院和州立大學的神經學家Timothy Jarome沒有參與這項研究,但做了相關工作。他指出:「這些休息在大腦中是正常的。我認為這是最令人驚訝的方面,因為這表明它一直在發生。」
為了進一步支持這一結論,科學家們還在被稱為神經膠質的非神經元腦細胞中觀察到雙鏈斷裂,在這種細胞中,神經膠質細胞調節著不同種類的基因。這一發現暗示了膠質細胞在記憶的形成和儲存中所起的作用,另外還暗示了DNA斷裂可能是許多其他細胞類型的調節機制。Jarome稱:「這一機制可能比我們想像的更為廣泛。」
但即使破壞DNA是誘導關鍵基因表達的一種特別快速的方法,無論是對記憶鞏固還是對其他細胞功能,它也有風險。如果雙鏈斷裂一次又一次發生在相同的位置並且沒有得到適當的修復,遺傳信息可能會丟失。此外,「這種類型的基因調控可能使神經元易受基因組損傷,特別是在衰老和神經毒性條件下,」Tsai說道。
「有趣的是,它在大腦中被如此頻繁地使用,」哈佛醫學院神經學家和遺傳學家Bruce Yankner表示,「而且細胞可以不受它的影響,而不會造成毀滅性的損害。」他也沒有參與這項新工作。
這可能是因為修復過程是有效的,但隨著年齡的增長,這種情況可能會改變。Tsai、Marshall和其他人正在研究這是否及如何成為阿爾茨海默病等疾病的神經退化機制。Yankner表示,它也可能導致神經膠質癌症或創傷後應激障礙。如果雙鏈斷裂調節神經系統外細胞的基因活性,這種機制的破壞也可能導致,如肌肉喪失或心臟病。
隨著對這一機制在體內的細節和用途的更好理解,它們最終可能會指導新的醫學治療的發展。Marshall指出,至少,考慮到雙鏈斷裂在基本記憶過程中的重要性,僅僅試圖防止雙鏈斷裂可能不是正確的方法。
但這項工作還表明,我們需要停止以靜態的方式思考基因組,而開始把它想像成動態的東西。Marshall說道:「無論何時你利用(DNA)模板,你都會擾亂模板,你會改變模板。這並不一定是一件壞事。」
他和他的同事們已經開始研究其他類型的DNA變化,這些變化跟調節失調和負面後果包括癌症有關。他們發現了這些變化的一些關鍵作用以及在調節基本的記憶相關過程。
Marshall認為,許多研究人員仍難以將DNA斷裂視為基因轉錄的基本調控機制。「它還沒有真正流行起來,人們仍然認為這是DNA損傷,」但他希望他的工作和Tsai團隊的新成果「將為其他人打開一扇門……以進行更深入的探索。」
來源:cnBeta
研究發現Long COVID和慢性疲勞綜合征有著明顯的相似之處
由約翰斯·霍普金斯大學醫學院的研究人員牽頭撰寫的一篇新的評論文章稱,日益突出的Long COVID病症與慢性疲勞綜合征有明顯的生理相似性。研究人員稱,更好地了解這兩種疾病之間的重疊,可以為未來許多種病毒後疾病的治療方法提供參考。
2020年初,在大流行的幾個月後,醫生開始注意到一些COVID-19的症狀在其他完全康復的病人身上揮之不去。這些症狀多種多樣,從性功能障礙到膀胱問題都有,但大多數患者都有幾個共同特點--疲勞、腦霧和運動能力下降。
這種情況被稱為Long COVID,最近在臨床上被標記為PASC(感染 SARS-CoV-2病毒的急性長期症狀)。迄今為止的研究表明,10%至30%的輕度COVID-19患者會出現幾個月的揮之不去的症狀。高達四分之三的嚴重住院病人報告有持續的症狀。
直到最近,慢性疲勞綜合症(CFS)仍被一些人認為更像是一種心理疾病而不是身體疾病。它也被稱為肌痛性腦脊髓炎(ME),通常在ME/CFS這個總稱下被提及,現在它被普遍接受為一種真正的慢性疾病,然而,它的起源仍然不清楚。
在美國有多達250萬人被認為患有ME/CFS。對許多患者來說,這種情況在某種急性病毒感染後迅速出現,出乎意料。
"......許多感染後疲勞的病例都是在急性感染之後出現的,而這些急性感染並不清楚會對心臟、肺部或腎髒造成永久性損害--而且是在沒有合並創傷後應激障礙或抑鬱症的人身上,"ME/CFS研究人員 Anthony Komaroff 和Lucinda Bateman在2021年初發表的一篇Long COVID論文中寫道。「特別是在ME/CFS的典型病例中,誘發的『類似感染性』疾病最常出現的是短暫的感染,或成為永久性的原發性感染,但通常不會產生慢性器官功能障礙(如發生在EB病毒感染者身上)。」
考慮到人們對ME/CFS知之甚少,聲稱該疾病與 long COVID相同肯定為時過早,但發表在《美國國家科學院院刊》上的一篇新文章表明,有證據表明這兩種疾病有類似的生物異常。
這篇新文章的主要作者Bindu Paul解釋說:「身體對感染和傷害的反應是復雜的,涵蓋所有的身體系統。當這種反應處於混亂狀態時--即使只是其中的一個方面--也會引起疲憊、腦霧、疼痛和其他症狀。」
Paul及其同事在文章中指出,COVID-19的急性病例和ME/CFS的患者都顯示出所謂的氧化還原失衡的跡象。這種情況涉及活性氧(可能包括自由基)和細胞內抗氧化劑防禦機制之間的不平衡。過量的活性氧會損害細胞成分並誘發炎症分子的產生。
文章中提出的假設是,這種氧化還原的不平衡導致系統性炎症和神經炎症,這也是long COVID和ME/CFS中看到的許多症狀的原因。研究人員謹慎地指出,這種氧化還原不平衡假說並不是作為兩種病症的單一原因提出的,而是為研究人員開始尋找未來的治療方法提供了方向。
「顯然,COVID-19引起的對肺部(慢性缺氧)、心臟(充血性心力衰竭)和腎髒(液體和酸鹼異常)的永久性損傷可能導致在長COVID-19中看到的一些持續的症狀,」 Paul和合著者在新文章中寫道:「在long COVID和ME/CFS中,其他症狀(如疲勞、腦霧)可能是由神經炎症、自主神經功能紊亂導致的腦灌注減少以及針對神經靶點的自身抗體產生的......」
Paul及其同事指出,目前有一些試圖解決氧化還原不平衡的治療方法。一些正在進行測試,以治療急性住院的COVID-19患者,還有一些已經進行了試驗,以改善ME/CFS患者的疲勞症狀。迄今為止,沒有一個被證明是特別有效的,研究人員認為氧化還原不平衡的異質性可能使其成為一個具有挑戰性的治療目標。
研究人員在文章中寫道:「然而,一般來說,針對恢復氧化還原平衡的口服療法並沒有對與氧化還原失衡有關的情況產生顯著的改善。沒有任何一種抗氧化劑能夠單獨清除或中和各種各樣的ROS和RNS。因此,上調對抗多種異常情況和加強抗氧化劑防禦和平衡的途徑可能更有益。干預的時機可能也很關鍵。」
總的來說,病毒性疾病後是一個明顯研究不足的領域,而對long COVID的日益關注提供了幾十年來對該主題的最大研究推動。來自哥倫比亞大學梅爾曼學院的ME/CFS研究人員Mady Hornig對早該關注的問題表示歡迎,並表示從對long COVID的新研究中獲得的見解有望為所有類型的病毒後疾病帶來新的治療方法。
「到目前為止,我們所看到的有趣的事情之一是,一些最初似乎在發展ME/CFS道路上的COVID-19患者實際上在四或五個月後開始感覺更好,"Hornig說。「我們認為,仔細觀察這些人並將他們與其他最終被診斷為ME/CFS的人進行比較,可以產生有價值的見解。他們的免疫系統是否有一些獨特之處,使他們更有彈性?這可能是為治療開辟新的可能性的那種發現。」
來源:cnBeta
新型潤滑塗層可以讓大腦植入物工作更長時間
據媒體報導,雖然大腦植入電極在恢復殘疾人功能等方面的應用顯示出了不小的發展潛力,但隨著時間的推移,它們往往會失去功能。不過現在一種新的塗層可以讓它們在植入後工作更長時間。大腦植入電極經常會導致身體的免疫系統將它們視為異物,這在植入最初導致會植入部位發生炎症,最終則會導致其周圍形成一層疤痕組織。
疤痕組織會極大地削弱了它們刺激鄰近神經元或監測神經活動的能力。
為了解決這個問題,韓國科學技術研究院(KIST)和韓國延世大學的科學家們開發出了一種新型的低摩擦植入電極塗層,叫潤滑免疫隱形探針表面(LIPS)。它的靈感來自於哈佛大學的SLIPS(全稱潤滑液體注入多孔表面)技術,而後者的靈感又來自於食肉豬籠草光滑的葉子。
LIPS被設計成用於現有的神經植入物,它由矽基組成並注入生物相容性全氟聚醚潤滑劑。雖然塗層並沒有使下面的電極變得更軟,但它能讓電極滑進大腦並對周圍的腦組織造成很小的變形或壓力。此外,LIPS的光滑性可以防止免疫細胞粘附,從而最大限度地減少疤痕組織的形成。
科學家們將這種塗層應用於由32個電極組成的神經探針上並將其植入大鼠的大腦中。結果發現,在植入後不久,超90%的電極能檢測到神經活動--這是接受無塗層探針的對照組老鼠記錄的數量的兩倍,後者發生了更多的炎症。
此外,在被疤痕組織包裹之前,未包裹的探針只能探測約一個月的大腦信號,而LIPS包裹的探針卻能探測四個月。
科學家們希望,一旦進一步發展,這種塗層也可以用於延長其他類型的醫療植入物的使用壽命。由KIST的Cho Il-Joo博士和延世大學的Jung-Mok Seo博士領導的這項研究已經在《Adavanced Science》發表了相關論文。
來源:cnBeta
研究:感染Delta變體的未接種疫苗者住院治療的可能性增加了一倍
據媒體New Atlas報導,發表在《柳葉刀·傳染病》上的一項新研究對SARS-CoV-2的Delta變體的毒性增加進行了迄今為止最徹底的調查。研究發現,與之前的變體感染者相比,感染Delta變體的未接種疫苗者住院治療的可能性增加了一倍,然而,無論何種變體,接種疫苗仍能有效保護個人免受嚴重疾病的影響。
在過去的幾個月里,Delta變體的快速傳播深刻地改變了這種全球大流行病的進程。在短短幾個月內,該變體迅速成為主導,證實了它與以前的病毒形式相比,傳染性要強得多。然而,雖然很清楚Delta的傳染性更強,但還不清楚它是否會導致更嚴重的疾病。
這項經同行評議並發表在《柳葉刀·傳染病》雜誌上的新研究,調查了今年3月至5月間英國約43000個COVID-19確診病例的數據。研究人員觀察了入院情況,將感染Delta變體的患者與感染先前主導的Alpha變體(也稱為英國變體)的患者進行了比較。
在考慮了諸如年齡和疫苗接種狀況等因素之後,研究得出結論,與感染了Alpha變體的人相比,那些感染了Delta變體的人住院的可能性要高2.26倍。Delta感染者到急診室接受治療的可能性仍然比Alpha感染者高1.45倍。
也許最重要的是,這種住院風險的增加在接種疫苗的受試者中沒有發現。在這項研究中跟蹤的所有住院病人中,有98%是未接種疫苗或部分接種疫苗的受試者。所有住院的人中只有2%是完全接種疫苗的人。
劍橋大學的Anne Presanis是這項新研究的主要作者之一,她表示:「我們的分析強調,在沒有疫苗接種的情況下,任何Delta的爆發都會給醫療保健帶來比Alpha流行病更大的負擔。全面接種疫苗對於降低個人首先感染Delta病毒的風險至關重要,而且重要的是,可以降低Delta病毒患者罹患嚴重疾病和住院的風險。」
埃克塞特大學的研究人員David Strain說,確認Delta變體導致更嚴重的疾病並不令人驚訝。他說,使Delta更具感染性的兩個因素導致了更大的毒力,這是合理的。
Strain解釋說,第一個因素是Delta在感染的早期階段能夠更快地復制。這意味著除了能更多地傳播給他人之外,它還能更迅速地在人體中傳播。Delta變異「工具包」的第二部分是一個刺突糖蛋白的修改,使其能夠更快地穿透細胞。
Strain說:「更多的病毒復制和更好的細胞滲透相結合,使得細胞、組織和器官更有可能在免疫系統,特別是未接種疫苗的個人的免疫系統有機會進行防禦之前就變得不堪重負。」
同一個英國研究小組以前的一項研究在11月至1月間跟蹤了COVID-19病例,以量化Alpha變體的嚴重程度。該研究發現,與SARS-CoV-2的原始毒株相比,Alpha病例住院治療的可能性高出52%。
雖然這些新發現是對疫苗接種在保護一個人免受嚴重影響方面的重要性的相關提醒,但COVID-19研究也是對未接種疫苗的國家所面臨的Delta變體的危險的令人擔憂的預示。研究人員Jerome Lechien和Sven Saussez對這項新研究的評論認為,這些發現應該為全球疫苗接種工作增加緊迫性。
Lechien和Saussez寫道:「Twohig及其同事的研究中最重要的發現是,在未接種疫苗的人群中爆發的Delta變體可能會導致比Alpha變體更大的醫療服務負擔。這一信息對未來的決策非常重要,為在對疫苗有抗藥性的新變體擴散之前在全世界加強疫苗接種計劃提供了額外的論據。」
來源:cnBeta
研究表明部分免疫系統受損患者對COVID-19疫苗沒有有效的免疫反應
英國一項正在進行的調查免疫力低下受試者對COVID-19疫苗反應的早期數據表明,這一群體中多達60%的人對目前的疫苗有有效的免疫反應。除了確定那些最容易出現次優疫苗反應的患者亞群外,這項研究還在研究免疫力低下患者的加強針的有效性。
由於疫苗臨床試驗通常招募健康的成年人群,他們無法深入了解高危人群的反應情況。在過去的幾個月里,越來越多的證據已經開始積累,表明那些免疫系統較弱的人可能不會對COVID-19疫苗作出有效反應。
這一數據導致一些國家開始為免疫力低下的人群提供第三劑的強化治療方案。然而,對這些病人群體的詳細免疫學研究是有限的。
2021年初,隨著COVID-19疫苗開始在普通人群中廣泛接種,一項大型研究開始關注免疫力低下患者的反應。該研究被稱為OCTAVE(SARS-CoV-2的觀察隊列試驗T細胞抗體和疫苗療效),計劃在各種免疫力低下的亞組中招募3000多名受試者,包括終末期腎髒病或肝病患者、接受免疫抑制治療的胃腸道疾病患者、血管炎、類風濕性關節炎、癌症和接受干細胞移植的患者。
「疫苗計劃的推出對這些脆弱的患者群體極為重要,然而,由於他們的基本醫療條件和治療方法會削弱他們的免疫系統,我們擔心有這些醫療條件的人可能無法獲得最佳保護,因此,調查這個未解答的問題過去和現在都極為重要,」領導OCTAVE研究的Iain McInnes解釋說。
OCTAVE研究的初步數據現在已經發表在《柳葉刀》的預印本伺服器上。這些結果尚未經過同行評審和正式發表,包括研究中的首批655名受試者。
研究在血清學免疫反應方面發現,整個隊列中有40%的人對兩劑COVID-19疫苗產生了低於標準的抗體反應,而健康成年人的反應是平均的。研究中約有11%的患者在兩劑疫苗後的四周時間內根本沒有產生任何抗體。
90%的ANCA相關血管炎患者對COVID-19疫苗的反應很差,令人震驚。這組患者大多正在接受一種名為利妥昔單抗的藥物治療。其他低反應的患者群包括54%的炎症性關節炎患者和51%的肝臟疾病患者。在另一端,只有17%的實體癌患者和21%的血液透析患者對COVID-19疫苗表現出次優反應。
愛丁堡大學的傳染病研究員Eleanor Riley說:「總的來說,正如預測的那樣,正在服用藥物來抑制他們的B細胞(也就是製造抗體的細胞)的人反應最不理想。然而,其他一些潛在的『風險』群體實際上反應相當好,這意味著他們並不像我們可能擔心的那樣『有風險』。這些信息對臨床醫生為病人提供建議將非常有用。」
OCTAVE研究正在進行中,並且正在擴大,包括調查這些脆弱的病人群體對目前在英國推出的加強針的反應。McInnes說,這是一個好消息,迄今為止,60%的研究對象對COVID-19疫苗接種反應良好。
「雖然這些臨床上有風險的群體中有40%的人在接種兩劑疫苗後被發現有低的或檢測不到的免疫反應,但我們對這個數字沒有更高感到鼓舞,」McInnes說。「然而,即使是部分保護也有可能對臨床有益,這也是我們將密切關注的問題。」
這項新研究已經發表在《柳葉刀》的預印本伺服器上。
來源:cnBeta
縮小啤酒肚的對策,終於來了
肥胖會引起一系列健康問題,而問題最大的肥胖類型要數內髒脂肪過度積累引起的肥胖,外觀的表現就是腹部的「游泳圈」、「啤酒肚」。腹腔深處,脂肪包圍著重要的器官,為各種基本功能提供支持;但是如果內髒脂肪過於豐富,對鄰近組織和器官就會產生慢性炎症等負面影響。 過量的內髒脂肪非常危險,而且還很難消除。一些研究發現,即便管住嘴刻意少吃,也很難有效減少腹部脂肪。
葡萄牙Champalimaud研究與診斷中心的科研小組決定著手探索「自然燃脂」的機制,希望從中找出潛在的臨床應用。最近,他們的研究成果登上了頂尖學術期刊《自然》。在這篇論文中,研究人員首次揭示了神經系統和免疫系統通過相互作用指導內髒脂肪存儲的過程。這一發現為對抗肥胖和肥胖相關疾病提供了多種新的對策。
很多人或許以為內髒脂肪就是均勻的一大坨油脂,實際上里面除了脂肪細胞,還含有神經纖維和多種類型的細胞,包括免疫細胞。
其中一種叫ILC2(2型天然淋巴細胞)的免疫細胞引起了這支研究小組的注意。「ILC2在很多組織和器官里對各種免疫功能至關重要,包括維持脂肪組織的健康狀態。」研究一作Ana Filipa Cardoso博士介紹。
他們發現,內髒脂肪中,神經末梢與ILC2之間的交流需要一個關鍵的「中介」:間充質細胞(mesenchymal cell)。
這一發現出人意料,因為很長時間以來,間充質細胞只被看作是組織中的「腳手架」。研究負責人Henrique Veiga-Fernandes教授說:「間充質細胞一直以來被廣泛忽視,直到最近十多年,科學家們才發現,間充質細胞發揮多種重要的積極作用。」
一系列實驗指出,脂肪組織中的間充質細胞就像翻譯,接收到交感神經末梢發送的信號後,向ILC2發送信息,然後由ILC2命令脂肪細胞增強脂質代謝、消耗能量,避免過量脂肪引起胰島素抵抗和肥胖的傾向。研究人員指出,間充質細胞在內髒脂肪組織中扮演的角色,非常適合用來精準調節其他細胞的活動。
在確認了內髒脂肪的這一燃脂機制後,研究小組繼續追溯源頭,尋找交感神經末梢的信號是從哪里來的。「內髒脂肪中的神經纖維屬於外周神經系統,但它們不是『老闆』,它們受到大腦所屬的中樞神經系統的指揮。」 Cardoso博士解釋。
利用逆行示蹤技術和外科手術、化學遺傳學等操作,最終研究人員確認,下丘腦室旁核(PVH)位於這條神經環路的上級指揮中心。下丘腦在大腦底部,是一系列重要過程的控制中心,包括新陳代謝、生殖、胃腸道和心血管功能。
「這一發現意義重大。」Veiga-Fernandes教授說,「我們第一次發現這樣的神經環路,這條長距離的神經環路將大腦信息轉化為與肥胖有關的免疫功能。」
這一發現進一步引出了許多新的問題,例如,是什麼觸發下丘腦室旁核發出「燃脂」的指令,與特定的飲食或鍛鍊有關嗎?還是依賴內部的代謝信號?找出這些問題的答案,對於預防和治療肥胖具有指導意義。
研究小組表示,在他們揭示的長距離、多步驟過程中,有多個可能的切入點,有望調節內髒脂肪燃燒,對抗肥胖並降低心血管疾病、癌症等與肥胖有關的疾病的風險。
據Veiga-Fernandes教授期待,目前研究機構下屬的初創公司LiMM正在計劃靶向神經免疫過程,轉化為創新的治療方法。期待研究人員的發現早日帶來臨床應用。
來源:cnBeta
研究:得益於皮膚細菌,蝙蝠蠅才找到可以吸血的蝙蝠
據媒體報導,我們人類並不是唯一需要擔心蚊蟲叮咬的動物。有成千上萬種昆蟲已經進化成專門以不同的哺乳動物和鳥類為食,但科學家們仍在研究這些昆蟲是如何區分不同物種來追蹤它們偏愛的獵物的。
事實證明,這種吸引力甚至可能不是皮膚深處的:《Molecular Ecology》上的一項新研究發現,專門捕食蝙蝠的吸血蒼蠅可能會通過追蹤蝙蝠皮膚上細菌產生的化學物質的氣味來定位它們偏愛的宿主。
這項研究的論文主要作者Holly Lutz從之前的研究中獲得了這個項目的靈感,該研究表明蚊子似乎更喜歡某些人而不是其他人。「你知道當你去燒烤,你的朋友被蚊子轟但你沒事?有一些研究支持這樣的觀點:蚊子吸引力的差異跟你的皮膚微生物群有關。考慮到有些人更容易被蚊子吸引,我想知道是什麼讓昆蟲被一些蝙蝠吸引而不被其他蝙蝠吸引,」Lutz說道。據悉,Lutz是芝加哥菲爾德博物館的研究助理,也是加州大學聖地亞哥分校Jack Gilbert(本研究的合著者)和Rob Knight實驗室的項目科學家。
據了解,Lutz曾在肯亞和烏干達的蝙蝠洞穴進行研究瘧疾的實地考察時遇到了很多蝙蝠。「在這些洞穴里,我會看到所有不同的蝙蝠物種甚至分類科在一起棲息。其中一些(蝙蝠)身上爬滿了蝙蝠蠅,而另一些則沒有或只有幾個。這些蒼蠅通常是針對不同種類的蝙蝠的--你不會發現一隻通常以馬蹄鐵蝙蝠為食的蒼蠅在果蝠身上爬行,」Lutz說道,「我開始想知道為什麼這些蒼蠅如此特別--顯然,它們可以從一種蝙蝠爬到另一種蝙蝠,但它們似乎並沒有這樣做。」
這些蒼蠅是蚊子的近親,雖然從技術上講它們是蒼蠅但大多數實際上不會飛。「在很多情況下,它們的翅膀都不可思議地縮小了,實際上無法飛行,」Lutz介紹道,「它們的視力下降了,所以它們可能不是真的靠視力操作。所以一定是其他感官機制在起作用,可能是嗅覺或檢測化學線索的能力。」
「蒼蠅是如何找到蝙蝠的,這在以前一直是個謎,」菲爾德博物館的研究助理、西肯塔基大學的生物學教授Carl Dick說道,「但因為大多數蝙蝠蠅只以一種蝙蝠為食,很明顯,它們以某種方式找到了正確的宿主。」他也是這項研究的論文合著者之一。
此外,蝙蝠蠅在蝙蝠之間傳播瘧疾,瘧疾寄生蟲也具有宿主特異性。這是一個復雜的系統,跟其他病媒傳播途徑有重要的相似之處,如瘧疾和按蚊在人類之間的病毒傳播。此前的研究表明,與人類皮膚甚至疾病狀況相關的不同細菌種類會影響尋血蚊子的進食偏好。
Lutz懷疑,跟在人類身上觀察到的情況類似,蝙蝠的皮膚微生物群可能在吸引蒼蠅尋找它們方面發揮了作用。皮膚--無論是人類的還是蝙蝠的--都覆蓋著微小的微生物,這些微生物有助於保護身體免受病原體的入侵、增強免疫系統並分解汗液等自然產物。宿主物種跟它們的皮膚微生物群一起進化,並導致不同的物種成為不同種類細菌的家。
所有這些不同種類的細菌在代謝營養物質時產生一種獨特的空氣化學物質。根據Ltz的假設,不同種類的昆蟲被不同的化學信號所吸引,這可以幫助解釋為什麼有些蝙蝠對吸血蒼蠅更有吸引力。
為了驗證這一假設,Lutz研究了數十種不同種類的蝙蝠。他說道:「我們進入了大量不同的洞穴,在它們棲息的地方使用長蝠網來捕捉它們,這基本上就像超級堅固的蝴蝶網。」她和她的同事從蝙蝠的身體和翅膀上提取了皮膚和皮毛樣本以檢驗蝙蝠的DNA和皮膚上的微生物。研究人員還檢查了蝙蝠上的蒼蠅。「你使用鉗子刷蝙蝠的皮毛,就像你在追逐最快的小蜘蛛。蒼蠅可以在一瞬間消失。它們令人毛骨悚然。」
Dick表示:「蒼蠅精巧地進化到能留在蝙蝠身上。它們有特殊的梳子、刺和爪子從而將它們固定在毛皮中,它們可以快速朝任何方向奔跑以躲避蝙蝠的咬抓或躲避研究人員的捕捉。」
研究人員隨後在菲爾德博物館的普利茲克DNA實驗室分析了這些樣本。「我們一回到實驗室,就從細菌中提取了所有的DNA並進行了測序。我們基本上創建了跟每個皮膚樣本相關的所有細菌庫。然後,我們使用生物信息學方法來描述那里的細菌並確定哪些細菌存在於不同的蝙蝠群體中,將被蒼蠅寄生的蝙蝠跟沒有被蒼蠅寄生的蝙蝠進行比較,」Lutz說道。
研究小組發現,即使蝙蝠是從不同的地方收集的,不同的蝙蝠科有自己獨特的皮膚細菌組合。「這項研究的目的是問,『這些不同蝙蝠的皮膚微生物群有差異嗎?有寄生蟲的蝙蝠和沒有寄生蟲的蝙蝠之間有常見的細菌嗎?』」Lutz反問道。
然而仍有一些重大問題需要回答。「在最初的工作中,我們無法收集產生線索的實際化學物質--次生代謝物或揮發性有機化合物。如果沒有這些信息,我們就不能肯定地說這些細菌是在把蒼蠅引向它們的宿主。因此,下一步將是用一種我們可以將這些化合物與細菌聯系起來的方式對蝙蝠進行取樣。在科學上,總有下一步,」Lutz指出。
除了解釋失明的、不會飛的蒼蠅是如何挑剔它們賴以為生的蝙蝠之外,這項研究還探討了不同生物如何共存的更大問題。Lutz表示:「我們生活在這些復雜的社區中,不同類型的生命總是相互碰撞、相互作用,有時還互相依賴或吃掉對方。在健康的自然狀態下,這些生物體將自己分開,這樣它們就可以共存。但隨著棲息地被破壞,生物被迫共享資源或開始利用新的資源。」以前可以相互保持距離的動物可能再也不能這樣做了,這可能會導致新的疾病從一種生物體傳播到另一種生物體。
「人類正在影響這些生態系統,而這些生態系統反過來也會影響我們,」Lutz說道,「這就是為什麼研究它們很重要。」
來源:cnBeta
研究:免疫細胞調節肽可幫助實驗鼠預防1型糖尿病
據媒體報導,根據對培養的人類細胞和活老鼠的新測試,一種被稱為MOTS-c的肽在預防1型糖尿病方面表現出前景。這種肽似乎可以調節免疫系統,它可能有助於治療1型糖尿病和其他自身免疫疾病。1型糖尿病開始於患者的免疫系統錯誤地攻擊胰腺中產生胰島素的細胞。
由於血液中的胰島素減少,身體無法將葡萄糖轉化為細胞所需的能量,需要患者根據需要手動注射胰島素。
但在這項新研究中,南加州大學和首爾國立大學的研究人員可能找到了防止這種破壞的方法。關鍵是一種被稱為MOTS-c的肽,該團隊此前已經證明,這種肽可以模擬鍛鍊的好處並提高老年小鼠的健康和整體健康水平。
有趣的是,MOTS-c實際上並不是由我們細胞中的主要基因組編碼的。相反,它是在線粒體中產生的,線粒體是為細胞提供能量的細胞器,其包含它們自己的基因組。
研究人員在這項新研究中將老鼠改造成1型糖尿病,然後給它們注射MOTS-c。果然,這種治療阻止了動物細胞的破壞並防止了小鼠出現高血糖。
MOTS-c似乎通過支持調節性T細胞發揮作用,這些細胞的任務是識別人體自身細胞和外來病原體的區別。這就減少了被激活攻擊胰島素產生細胞的殺傷T細胞的數量。
「我們能在小鼠模型中預防1型糖尿病的發病,」該研究的論文共同通訊作者Changhan David Lee指出,「MOTS-c注射似乎馴服了免疫系統,並告訴它不要處理自己的細胞。」
雖然這種治療還處於早期階段,但有跡象表明,這種結果可能會對人類產生影響。研究小組發現,1型糖尿病患者血液中MOTS-c的含量遠低於非糖尿病患者。在對培養的人類細胞進行的後續試驗中,MOTS-c治療降低了殺傷T細胞的激活,這跟在小鼠中的表現相同。研究人員還表示,這項技術可能適用於治療除1型糖尿病之外的其他自身免疫性疾病。
來源:cnBeta
科學家利用超聲波遠程激活免疫細胞 以攻擊小鼠腫瘤
據媒體報導,嵌合抗原受體T(CAR-T)細胞免疫療法是一種很有前景的潛在癌症治療方法,但它可能在健康組織中引發危險的副作用。現在,加州大學聖迭戈分校的研究人員找到了一種方法,通過設計CAR-T細胞,使其只在高溫下工作,然後用超聲波加熱腫瘤,從而更精確地集中治療。
免疫系統是我們抵禦病原體和其他有害細胞的第一道防線,但癌細胞可能很「狡猾」,使用一系列策略來躲避免疫細胞的檢測。為了使事情回到對病人有利的方向,免疫療法包括從病人身上取出T細胞,給它們「充電」以更好地瞄準癌症抗原,然後將它們送回體內。
結果令人難以置信地有希望,特別是針對血癌,但令人沮喪的是,該技術似乎對實體腫瘤的效果並不理想。問題的一部分似乎是被激活的免疫細胞,即CAR-T細胞,可能反應過度並開始攻擊低水平表達這些抗原的健康細胞。這可能導致一種潛在的致命的免疫狀況,即細胞因子風暴。
因此在新研究中,研究人員增加了一個觸發器,以確保CAR-T細胞只在腫瘤部位被激活,最大限度地減少其「脫靶」損害。他們用一種基因設計了CAR-T細胞,這種基因只有在受熱時才會產生CAR蛋白--然後,他們用聚焦的超聲波脈沖將腫瘤加熱到43℃。
該團隊通過給皮下腫瘤的小鼠注射熱激活的CAR-T細胞,然後在腫瘤部位使用一個小型超聲波傳感器來測試該技術。果然,與接受普通CAR-T細胞治療的小鼠相比,這種治療抑制了腫瘤的生長,同時減少了「脫靶」效應。
該研究的第一作者Shirley Wu說:「這表明我們的CAR-T細胞療法不僅有效,而且更安全。它具有最小的靶向、非腫瘤副作用。」
該團隊計劃在開始任何人體試驗之前進行更多的測試並調查毒性。
這項研究發表在《自然-生物醫學工程》雜誌上。
來源:cnBeta
微小的觸角顆粒可以偽裝植入物以避免免疫排斥反應
我們的免疫系統是保護我們安全的強大盟友,但有時它也會有點得寸進尺,攻擊那些試圖幫助我們的外來物甚至自身。現在,研究人員已經開發出了被稱為樹枝狀物的顆粒,這些顆粒覆蓋著微小的觸角,由於其實在太小,免疫系統無法檢測,可以方便地用於輸送藥物或偽裝植入物以防止排斥反應。 ...
科學家發現防止食物中毒能力取決於一天中的時間
據媒體報導,一項研究表明,天然抗菌分子的水平會隨腸道細菌引起的晝夜節律波動。來自德克薩斯大學西南分校(UTSW)的科學家們的一項新研究表明,人體通過產生一種天然抗菌化合物來防止食物中毒的能力在白天增強,而白天最可能暴露在有害細菌中。
這項發表在《Cell》網絡版上的研究最終可能會帶來定時治療和疫苗接種方案從而最大限度地提高這種免疫反應。
「這項研究表明,我們的免疫系統並非一直處於開啟狀態,這是一個意想不到的結果,」研究負責人John F. Brooks II說道,「我們的研究結果表明,人體在某些高峰期更容易對抗感染。」據悉,Brooks II是該研究的共同負責人、UTSW免疫學和微生物學教授Lora Hooper博士實驗室的博士後研究員。
研究人員早就知道,幾乎所有動物都會遵循跟日出和日落有關的晝夜節律周期。這些周期使動物能預測並准備好應對環境的變化。打亂晝夜節律會造成嚴重的健康後果,例慢性睡眠中斷跟人類腸道感染的增加有關。但為什麼會發生這種情況目前還不清楚。
Brooks、Hooper和他們的同事懷疑,腸道中的抗菌免疫可能是按晝夜周期變化的。為了研究這一觀點,研究人員在小鼠腸道中產生的對抗食源性疾病的天然抗菌劑的表達中尋找節奏。研究人員發現,在正常的實驗室小鼠中,一種被稱為再生胰島衍生蛋白3g (REG3G)的抗菌分子在夜間這些夜間動物活躍的時候含量更多,而在白天老鼠睡覺的時候含量更少。然而在沒有腸道細菌的小鼠中,REG3G基本上在白天和晚上都不存在。
在尋找驅動這種節律模式的微生物成分時,研究人員發現,REG3G循環量的小鼠腸道內有大量的節段絲狀菌--這些微生物通常存在於齧齒動物、非人類靈長類動物、還有人類--它們有一種獨特的能力,可以附著在腸道內壁上並改變宿主的基因活動。進一步的實驗表明,這些細菌在餵養過程中附著在動物的腸壁上,可能是為了吸走營養物質。當它們附著時,REG3G的產量在腸道內激增。
這種循環對老鼠抵抗感染的能力產生了重大影響。當研究人員用細菌感染正常老鼠時,如果它們在日落時暴露於環境,那麼它們的細菌負擔和死亡率要比在日出時高。無論何時被感染,不能產生包括REG3G在內的抗菌蛋白的小鼠都有同樣高的細菌負擔和死亡率。
如果進一步的研究表明,這種現象也發生在人類身上,那麼科學家們可能最終能夠利用它進而為腸道感染使用合成抗生素和口服疫苗或找到完全避免腸道感染的新方法。
來源:cnBeta
研究:脂肪「防爆罩」可幫助一些癌細胞躲避免疫系統攻擊
據媒體報導,人體的免疫細胞會對可能對我們造成傷害的病原體或危險細胞進行猛烈攻擊,其會使用蛋白質和酶攻擊它們進而撕開它們的保護膜。圍繞著這些自然殺傷細胞的一個謎團是,為什麼這些攻擊不會同時對它們自己的保護膜造成損害。
科學家們認為,他們已經在脂肪構成的「沖擊波防護罩」中找到了答案。據了解,脂肪也會在一些癌細胞中起作用並幫助它們躲避免疫系統的攻擊。
這項研究是由哥倫比亞大學的科學家領導,他們正在研究免疫細胞的工作方式並希望揭示它們自我保護能力背後的生物機制。
「自20世紀90年代初以來,我一直在研究自然殺傷細胞,每次我做關於這些細胞的演講,總會有人問這個問題,」這項研究的負責人、免疫學專家Jordan Orange說道。
Orange的同事、研究生Yu Li將注意力轉向了位於所有細胞外層的雙層膜,它由一種叫做脂類的脂肪構成。Li在顯微鏡下研究這些細胞時注意到,免疫細胞周圍的細胞膜比其他類型的細胞更有序、脂質密度也更大。
「關於為什麼自然殺傷細胞在攻擊其他細胞時不會殺死自己有很多假設,但它們都提出可能有一種神奇的、未知的蛋白質保護這些細胞,」Li說道,「基於生物物理的考慮,我認為蛋白質不足以保護細胞。當我觀察這些細胞時我想到了脂質。」
為了驗證脂質理論,Li進行了實驗。在實驗中,他將細胞膜置於一種能削弱脂質層的化合物中。這種較低的密度和較不整齊的膜使免疫細胞在很大程度上不受自身「有毒原細胞」的保護從而能夠殺死它們及它們的目標細胞。
進一步的研究表明,當免疫細胞准備發動攻擊時,它們會做一些准備。這包括將裝滿致命物質的小顆粒移向薄膜的外邊緣以此來達到釋放其有效載荷的目的。在此過程中,它們自身的緻密脂膜會分解並跟免疫細胞的脂膜融合從而起到關鍵的結構加固作用。
「從本質上說,Li發現薄膜變成了一個防爆罩,」Orange指出,「這種保護來自於膜脂的排列方式。當脂質排列更加有序時就會有更多的脂質被包裹進膜中。有毒物質則根本無法進入細胞膜。」
科學家們知道,一些癌細胞能夠保護自己免受免疫細胞的攻擊,而這種沖擊波屏障或許可以解釋其中的原因。Li利用已知表現出這種行為的侵襲性乳腺癌細胞進行了實驗,結果發現它們也能以這種方式加強細胞膜。當添加這種化合物來削弱脂質層時癌細胞就會變得很容易受到攻擊。
「我們還不知道這是否是癌細胞抵抗自然殺傷細胞的一般機制,」Li說道,「如果它是可推廣的,那麼我們可以開始考慮破壞腫瘤細胞膜使其更容易受到免疫系統攻擊的療法。」
來源:cnBeta
研究發現用TSLP細胞因子方法治療小鼠後 可導致其通過「出汗」減少脂肪
據媒體報導,科學家們的一個有趣發現可能會導致未來對肥胖症的治療。研究人員發現,與實驗中的對照組相比,用一種被稱為TSLP細胞因子的方法治療小鼠,導致腹部脂肪明顯減少,體重下降。研究人員並不是為了找到一種潛在的治療脂肪減少的方法。相反,這是一個意想不到的副作用。
研究人員注意到小鼠正在出汗,這似乎是一個良性的觀察。用TSLP治療的小鼠表現出油膩的毛發。然而,研究小組表示,脂肪的減少並不與食物攝入量的減少或新陳代謝的加快有關。相反,他們發現TSLP刺激免疫系統通過皮膚的產油皮脂腺釋放脂類。
主要研究人員Taku Kambayashi說,這一發現是完全沒有預見到的。該團隊已經證明,通過從皮膚中以富含能量的皮脂形式分泌熱量,可以實現減脂。該團隊認為他們是第一個顯示出誘導這一過程的非荷爾蒙方式的小組,突出了他們所說的免疫系統的一個意外作用。
胸腺基質淋巴細胞生成素(TSLP)是一種參與哮喘和其他過敏性疾病的免疫系統蛋白。該小組正在研究該細胞因子的擴大作用,以激活2型免疫細胞和擴大T調節細胞。以前的研究發現這些細胞可以調節能量代謝,研究預測用TSLP治療超重小鼠可以刺激免疫反應,有可能抵消肥胖的一些有害影響。
該團隊並不期望TSLP對肥胖症本身產生影響。相反,他們想確定TSLP是否能影響胰島素抵抗。他們最初的目標是糾正2型糖尿病,而不導致小鼠體重減輕。雖然還需要更多的研究,但作者認為這一發現有可能導致人類的「出汗脂肪 」和體重下降。
來源:cnBeta
萊斯大學的研究人員為糖尿病患者創造了一種能產生胰島素的植入物
萊斯大學的生物工程師們利用3D列印和智能生物材料,為1型糖尿病患者創造了一種能產生胰島素的新型植入物。這一突破是研究人員與青少年糖尿病研究基金會之間為期三年的合作的結果。研究人員使用由人類干細胞製成的產生胰島素的β細胞,創造了一種能夠感知和調節血糖水平的植入物,在特定時間內以正確的胰島素量作出反應。
研究人員Omid Veiseh和Jordan Miller已經在這個項目上工作了十多年。Veiseh說,要再現胰腺的正常工作,需要有血管。胰腺有很多血管和細胞,它們以特定的方式組織,研究人員希望列印出這樣與自然界中存在的對應組織。
1型糖尿病是一種自身免疫性疾病,會導致胰腺停止產生胰島素。胰島素是一種控制血糖水平所需的荷爾蒙,在美國約有160萬人患有1型糖尿病,每天有100多個病例被診斷出來。要控制病情需要通過注射胰島素來管理,但在日常飲食、運動和其他活動中穩定管理胰島素注射一直被認為是困難的。
研究人員的目標是證明他們的植入物能夠正確調節糖尿病小鼠的血糖水平,至少持續六個月。要做到這一點,需要他們設計出能夠快速響應血糖變化的β細胞。理想情況下,產生胰島素的細胞距離血管不超過100微米。他們通過先進的3D生物列印技術和宿主介導的血管重塑,將預血管化結合起來。
這種組合使每個植入物都有幾次與宿主融合的機會。植入物中產生胰島素的細胞將受到一種水凝膠配方的保護,這種配方已被證明能有效地將細胞處理方法封裝在珠子大小的球體中。它們的孔隙小到足以讓里面的細胞不被免疫系統攻擊,同時又大到足以讓營養物質進入和胰島素從細胞中流出。
來源:cnBeta
不起眼的城市綠化帶也蘊含豐富微生物
一個國際研究團隊的最新研究發現,即使是城市里最不起眼的路邊綠化帶,也能給城市環境和人體健康帶來積極作用。研究人員從全球17個國家和地區的56個城市里不同類型的城市綠地採集土壤樣本並進行分析,最終形成全球首個城市公園微生物群評估研究報告。相關論文已發表在英國《科學進展》雜誌上。
參與這項研究的澳大利亞新南威爾斯大學生態系統科學中心教授戴維·埃爾德里奇說,這項研究表明,即使是城市道路兩旁窄窄的綠化帶,也並非不毛之地,土壤中蘊含著豐富的微生物。
研究發現,城市綠地中的微生物藉助化肥和灌溉用水,就可以迅速增殖,並能「進軍」尚未有植物覆蓋的土地。此外,已經有研究證明,人與城市綠地接觸的過程中,土壤中的微生物有助於改進人體免疫系統調節功能,減少過敏。
研究人員還表示,這些綠地不僅為人們提供了休閒娛樂的場所,還可以吸收二氧化碳、過濾城市污染物,減少城市噪音和降低溫度。因此,城市在進行規劃時應當重視綠地和公園,維護生態系統的可持續發展。
來源:cnBeta
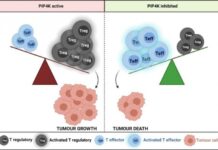
科學家發現潛在療法 可提高人類免疫系統在體內搜索和消滅癌細胞的能力
據媒體報導,一項新研究發現了一種潛在的治療方法,可以提高人類免疫系統在體內搜索和消滅癌細胞的能力。科學家們已經確定了一種限制調節免疫系統的一組細胞的活動的方法,這反過來可以釋放其他免疫細胞來攻擊癌症患者的腫瘤。
「病人的免疫系統更有能力檢測和清除癌細胞,免疫療法最近已成為許多不同類型癌症的一種新療法。」領導這項研究的南安普頓大學細胞信號學教授Nullin Divecha解釋說。他繼續說:「然而,癌細胞可以在腫瘤內產生一種微環境,阻止免疫系統的工作,從而限制了免疫療法的普遍使用和成功。」
免疫系統對癌細胞的檢測和清除部分是由一組稱為Teffector細胞(Teffs)的細胞完成的。Teff細胞在檢測和清除癌細胞方面的效果如何,部分是由其他T細胞決定的,它們被稱為調節性T細胞(或簡稱Tregs)。Tregs與Teff細胞進行物理互動,並產生分子,降低Taff細胞的正常工作能力。
Divecha教授補充說:「Tregs在人體中發揮著重要的功能,因為如果沒有它們,免疫系統就會失去控制,並攻擊人體的正常細胞。然而,在癌症患者中,我們需要給特夫細胞更多的自由來執行它們的工作。」
腫瘤細胞釋放的分子通過吸引和積累Tregs使問題復雜化,進一步降低Teff細胞的活性和功能。確實存在抑制Treg細胞的機制,然而由於Treg和Teff細胞非常相似,這些機制通常也會導致Teff細胞受到抑制。
在這項發表在《美國國家科學院院刊》上的新研究中,來自南安普敦大學和米蘭國家分子遺傳學研究所的科學家們表明,抑制細胞中一個名為PIP4K的酶家族可能是如何限制Tregs而不影響Taff的答案。
該研究小組從健康捐贈者身上分離出Tregs,並使用基因技術抑制PIP4K蛋白的產生。他們觀察到,Treg細胞中PIP4Ks的缺失阻止了它們的生長和對免疫信號的反應,因此這將阻止它們阻斷Taff細胞的生長和功能。重要的是,Teff細胞中相同酶的損失並沒有限制它們的活性。
進行實驗研究的Alessandro Poli博士說:「這令人驚訝,因為PIP4Ks在兩種類型的T細胞中的濃度相似,但我們的研究表明,它們似乎對Tregs具有比Teffectors更重要的功能。」
抑制PIP4K作為患者的潛在治療手段,需要開發出抑制性分子。「為此,我們表明,用一種類似於PIP4K抑制劑的藥物進行治療可以使免疫系統的功能更強,並能更好地消滅腫瘤細胞。」
來源:cnBeta
為什麼我們會對糞便產生厭惡感?
7月23日消息,作為遊戲之夜派對的一部分,整蠱者會製造一場惡作劇,他會拿出一個裝有神秘物體的盒子,讓玩家蒙上眼睛,僅通過雙用觸摸和鼻子嗅聞來識別它,當玩家小心翼翼地將手伸入盒子里,摸到該物體十分濕軟,並且又粘又臭,他會立即發瘋地從椅子上跳起來,因為它摸起來太像糞便了!但事實上,整蠱者是用酸奶酪和麵包屑製作的一種混合物。
資料圖
並不是說我們應該觸摸糞便來准確地了解它的質地,但是我們的大腦對觸摸糞便的感覺會有一種強烈的認知概念,我們會遠離任何聞起來有糞便味的物體。動物的糞便、人類的糞便、黏糊糊的糞便、固態糞便、黃色的糞便……幾乎所有人都對糞便感到厭惡。
人體是如何製造糞便?糞便的成分是什麼?
人類為了生存下來,必須從食物中獲取營養物質維持身體新陳代謝,當我們吃下食物,食物會進入人體消化系統,小腸會吸收食物中90%的水分,並從我們剛攝入的食物中吸收我們身體所需的營養物質。剩下的是無法消化的食物,它們通過大腸,在那里將未消化的食物變成了糞便。
大腸主要從未消化食物中吸收剩餘的水分,不過大腸中的細菌會進行更多的消化,最後排出人體的是一團凝固的糞便。糞便的主要成分有三種:水、細菌、未消化的膳食纖維,其中75%是水,固體物質中25-54%是活的、死的、無害和致病的細菌,還有未完全消化的食物纖維。
為什麼糞便有強烈的刺激味呢?
最令人厭惡的就是糞便的特殊氣味,這是腸道微生物活動的結果,糞便會釋放大量揮發性氣體,最常見的氣體是二氧化碳、氧氣、氫氣和甲烷,但惡臭氣味的根源是吲哚和糞臭素,這是由於腸道細菌作用於胺基酸色氨酸而形成的,色氨酸存在於大多數飲食中。
在這些揮發性化合物中,糞臭素具有一種強烈的氣味,人們吸入後會產生強烈的畏縮和厭惡感。
為什麼我們會對糞便感到厭惡呢?
人類糞便中的細菌可以導致一些可怕疾病,例如:霍亂、食物中毒和腹瀉,除了我們身體的自然防禦屏障(皮膚和復雜的免疫系統),我們還有一種行為免疫系統,阻止我們接近可能具有傳染性的物體,例如:糞便。
「厭惡反應」是許多物種的基本情緒之一,大多數身體分泌和排泄物會讓我們產生感染疾病的風險,厭惡被認為是一種迴避疾病的機制,或者是激發衛生保健的情緒。隨著進化和自然選擇的發生,那些設法遠離病原體的動物和物種存活下來並完成了進化。對於人類而言,厭惡反應是不由自主發生的,沒有任何有意識的「感到厭惡」的決定,因此,當遇到像糞便這樣令人討厭的刺激物時,會導致人們產生更加衛生保健的習慣,並試圖避免疾病感染。
避免疾病的行為並非人類獨有,即使是龍蝦,它們也會遠離其他患病的龍蝦!
我們學會了厭惡反應嗎?
厭惡作為一種情緒引起了許多科學家的濃厚興趣,各種大腦研究表明,當我們面對產生厭惡的刺激時,大腦前腦島和杏仁核區域會有顯著的大腦活動。
這就好像我們天生就對自己的排泄物感到厭惡一樣,因為它對人體健康構成了危險,糞便具有揮發性成分,糞便中的致病細菌,以及惡臭氣味會讓人們產生普遍的厭惡反應,這也是躲避疾病策略的一部分。
厭惡是一種強烈的普遍情緒反應,但它發生的強度不同,有時候我們會覺得惡心,但有些事物可能會讓你感到更惡心。此外,在某些情況下,你可能會忍受別人覺得惡心的事物,例如:嬰兒的母親對孩子的糞便厭惡感遠不如街頭上看到的糞便,在該情況下,母親對孩子糞便的厭惡感實際上會大大降低。
同樣我們看到別人的糞便,會比看到自己的糞便感到更惡心,這是因為我們意識到他人的糞便會帶來新的病原體;這種潛意識比在廁所里目睹自己的糞便更讓我們「不寒而慄」!
人類每天進食,然後排泄糞便,一天天地重復,事實上,我們應該感謝人體產生對糞便的厭惡感,排泄糞便是一種令人厭惡的誘導因素,所以我們通常遠離糞便和糞便所攜帶的致病細菌。總之,人們厭惡糞便並不總是帶來負面效應,值得慶幸的是,人體奇妙的消化系統和行為免疫系統有助於人類安全地生存下來!
來源:cnBeta
新的研究揭示了我們的免疫系統如何對COVID-19變種做出反應
中和抗體是我們免疫系統前線武器庫的一部分,在感染和疫苗接種期間被觸發。它們的工作是保護通常是病原體(如引起COVID-19疾病的SARS-CoV-2病毒)目標的細胞不被感染。中和抗體反應的水平可以成為我們的身體如何有效抵禦疾病的一個決定性特徵。
有趣的是,一個罕見的 "超級反應者"群體也被確定為一個例外。
這組 "超級反應者"在所有COVID-19變種中都有穩定和強大的抗體水平。研究人員說,這個群體可能被證明有助於調查療養血漿的潛力(使用已經康復的人的血液來治療其他人),迄今為止,療養血漿被證明對重症COVID-19疾病沒有效果。此外,可以密切關注關鍵的捐贈者,並克隆他們的抗體用於未來的治療。
雪梨大學和雪梨兒童醫院網絡的兒童研究部的共同第一作者Fabienne Brilot副教授和她的研究團隊領導了該研究的分析分支,使用他們開發的高度敏感的工具來詳細研究抗體。"我們可以從這些在澳大利亞的第一波感染者身上學到很多東西,因為他們感染的是我們目前的疫苗所基於的相同變種,"Brilot副教授說。"雖然已批準的疫苗顯示出良好的反應,但我們的研究強調了繼續開發疫苗的重要性,特別是考慮到變種的差異"。
共同第一作者、科比研究所的Stuart Turville副教授說,開展這項研究是為了調查COVID-19感染產生的免疫力的水平、廣度和壽命,以及病毒的變異是否會損害免疫力。
"這項工作讓我們看到的是,目前對疫苗的觀察顯示,它們對COVID-19及其變種的保護要比感染後身體的自然免疫反應廣泛得多,後者通常只對人所感染的病毒變種有保護作用。因此,我們不應該依靠人體的自然免疫反應來控制這種大流行病,而應該依靠現有的廣泛保護性疫苗"。
來源:cnBeta
輝瑞/BioNTech建議可能需要接種第三劑加強針疫苗 但美官員認為為時過早
據媒體New Atlas報導,COVID-19疫苗的加強針何時才有必要?輝瑞公司最近聲稱,在完全接種後的6至12個月內,可能需要接種第三劑加強針疫苗,但並非所有人都認同這點,一項新研究發現mRNA疫苗可以提供多年的保護。
輝瑞公司和BioNTech最近發布的一份新聞稿提供了他們正在進行的臨床試驗的最新情況,該試驗測試了他們目前的mRNA疫苗在第二劑接種6個月後進行第三劑加強針接種的效果。聲明中沒有概述具體的數據,相反,這些公司只是指出,在首次接種疫苗六個月後進行的加強針接種能產生高水平的保護。
「......我們已經說過,而且我們仍然認為,根據我們迄今掌握的全部數據,很可能在全面接種後的6至12個月內需要接種第三劑,」這兩家公司在新聞稿中說。「雖然在整個6個月內對嚴重疾病的保護仍然很高,但隨著時間的推移,對有症狀的疾病的療效會下降,而且預計會繼續出現變異。」
美國疾病控制和預防中心(CDC)和美國食品和藥物管理局(FDA)罕見地發表了一份聯合聲明,對輝瑞公司和BioNTech的加強針聲明進行了反駁。聯邦機構注意到最近幾乎所有的COVID-19死亡和住院病例都是未接種疫苗的人,並表示目前沒有證據表明有必要進行加強針接種。
聯合聲明指出:「已經完全接種疫苗的美國人目前不需要再接種加強針。我們將繼續審查任何可獲得的新數據,並將向公眾通報。如果科學證明需要加強針劑量,我們已經准備好了。」
本周早些時候,輝瑞公司和BioNTech公司的代表與美國高級衛生官員進行了閉門會談,提出了他們的數據,主張進行第三劑加強針疫苗接種。者被白宮首席醫療顧問安東尼·福奇描述為 "禮節性會議",美國官員在討論中沒有說服力地認為目前有必要進行加強針接種。然而,福奇確實強調這可能在未來的任何時候發生變化,盡管現在沒有證據表明有必要進行第三劑加強針接種。
福奇在會後接受CNBC采訪時說:「關於加強針的討論實際上是(藥物)公司與NIH和CDC及其他機構一起進行的適當准備,以便在你可能需要加強針的情況下做好准備。」
輝瑞公司和BioNTech公司計劃在幾周內向監管機構提交其加強針試驗的全部數據。此外,這兩家公司用來推動第三劑加強針的數據文章應該很快出現在同行評議的雜誌上。
美國國家衛生研究院院長柯林斯在一篇博文中稱,輝瑞和BioNTech公司的加強針建議為時過早。他表示,到目前為止,疫苗保護看起來很強大,包括關於Delta等新興變種的新數據。
柯林斯特別引用了最近發表在《自然》雜誌上的一項研究,該研究提供了有希望的跡象,mRNA疫苗產生了持久的保護。這項獨特的研究在輝瑞公司接種疫苗後對14名參與者進行了15周的跟蹤。在研究過程中,在幾個點上進行了淋巴結活檢,研究人員在這些組織樣本中調查了「生發中心」的活動。
柯林斯解釋說:「淋巴結是人類免疫系統建立所謂的『生發中心』的地方,其功能是「訓練營」,「教導」未成熟的免疫細胞識別新的疾病威脅並以後天的效率攻擊它們。在這種情況下,'威脅'是由疫苗編碼的SARS-COV-2的刺突糖蛋白。」
這項新研究的高級作者Ali Ellebedy說,這些「生發中心」在整個15周的研究中有效地產生了針對刺突糖蛋白的B細胞。而且,在研究結束後,研究人員繼續檢測到持續的「生發中心」活動,表明疫苗誘導的免疫力可能是持久的。
來源:cnBeta
太神聖!加拿大驚見「純身雪白烏鴉」 志工一看:牠是來求助的
都說天下烏鴉一般黑,但今年初夏,加拿大不列顛哥倫比亞艾靈頓(Errington)卻出現了一隻白烏鴉。牠身上有一些傷口,看起來非常虛弱。一位好心人將牠送到北島野生動物恢復中心(NIWRA)。恢復中心的主管Derek Downes說:「看到那隻鳥的一刻,我就知道牠有多特別!」
▼白烏鴉在當地有重大的意義,自1990年代以來,該地一直有白烏鴉的紀錄,但白烏鴉往往很難活下來。Downes給這隻白烏鴉服用抗生素、維他命和其他營養補充劑。牠無法自己進食,Downes還要用餵食管一點一點餵給牠吃。
▼在Downes的照顧下,白烏鴉康復得很好。牠現在已經能夠自己進食了,身上的傷口也沒有感染。Downes認為,這隻烏鴉不同尋常的毛色跟白化病有關,這種基因突變導致牠的羽毛、皮膚上缺乏黑色素。
▼Downes說:「現在這隻白烏鴉的身體狀況非常好,已經能試著飛翔了。不過牠的免疫系統非常脆弱。」這隻白烏鴉的羽毛帶有一點點灰色,眼睛是藍色的,這並不完全符合白化病的特徵,但也讓Downes對牠的康復更有信心,因為患有白化病的白烏鴉免疫系統往往很脆弱。
▼罕見的白烏鴉:
白烏鴉在當地是一種非常特別的動物,還有深刻的文化意義。這隻白烏鴉在恢復中心被照顧得很好。雖然不知道牠還要在這里待多久,但一定會住得很舒服!
來源:網路資料
來源:花生時報wwwallother
牛津大學研製的新型HIV候選疫苗開始一期臨床試驗
據媒體報導,牛津大學本周開始對一種新型HIV候選疫苗進行接種,作為英國一期臨床試驗的一部分。這項被稱為HIV-CORE 0052的試驗的目的是評估HIVconsvX疫苗的安全性、耐受性和免疫原性--這是一種針對廣泛的HIV-1變體的混合疫苗,使其有可能適用於任何地理區域的HIV菌株。
13名健康的、HIV陰性的成年人,年齡在18-65歲,被認為沒有感染的高風險,最初將接種一劑疫苗,然後在四周後再接種一劑加強針。
該試驗是歐洲愛滋病疫苗計劃(EAVI2020)的一部分,這是一個國際合作研究項目,由歐盟委員會根據地平線2020健康計劃資助研究和創新。
牛津大學詹納研究所的疫苗免疫學教授、該試驗的首席研究員Tomáš Hanke教授說:「40年來,一種有效的HIV疫苗一直遙不可及。這項試驗是對這一新型疫苗戰略進行一系列評估的第一項,它既適用於HIV陰性個體的預防,也適用於HIV感染者的治療。」
大多數HIV候選疫苗通過誘導B細胞產生的抗體發揮作用,而HIVconsvX則誘導免疫系統強大的病原體湮滅T細胞,使它們針對HIV的高度保守和因此脆弱的區域--這是大多數HIV變體共同的「致命弱點」。
牛津大學詹納研究所高級臨床研究員、試驗首席研究員Paola Cicconi博士說:「實現對愛滋病毒的保護是極具挑戰性的,重要的是我們要利用免疫系統的抗體和T細胞的保護潛力。」
目前,愛滋病毒的預防主要集中在行為和生物醫學干預上,如男性自願醫學包皮環切術、安全套的使用以及在接觸前使用抗逆轉錄病毒藥物。
Tomáš Hanke 教授說:「有強有力的證據表明,檢測不到的HIV病毒負荷可以防止性傳播。然而,愛滋病毒新感染者的下降速度未能達到聯合國大會在2016年商定的快速通道目標:在2020年每年新感染者少於50萬人。」
「即使在增加抗逆轉錄病毒治療和預防的大背景下,HIV-1疫苗仍然是最好的解決方案,並可能是任何結束愛滋病流行的戰略的關鍵組成部分。」
研究人員希望能夠在2022年4月前報告HIV-CORE 0052試驗的結果。他們還計劃在歐洲、非洲和美國開始類似的試驗。
來源:cnBeta
癌症有疫苗! 首批人體實驗啟動:已有試驗者接受施打
新冠疫情在全球持續延燒,所有人都看到了疫苗的重要性。其實科學家們一直在開發各種各樣的疫苗,希望能夠打敗多種疾病。德國BioNTech就開發出了一種「癌症疫苗」,幫助人們遠離癌症。現在這種疫苗已經進入臨床試驗第二階段,首批患者接受注射。
▼BioNTech表示,這種疫苗已經足夠安全,能夠進行人體臨床實驗。罹患皮膚癌的患者注射疫苗後,還要配合處方藥Libtayo。如果治療效果比較好,對絕症患者來說不亞於重獲新生。
▼癌症疫苗的開發充滿挑戰,跟其他疫苗的試驗過程不一樣,科學家們不能給沒有罹患癌症的人注射,然後去看這種疫苗的效果。所以第一批接種疫苗的人都是3到4期皮膚癌患者。這種疫苗採用mRNA技術,透過刺激免疫系統製造抗體,從而起到保護作用。
BioNTech的聯合創始人表示,公司希望利用免疫系統本身的力量,來對抗癌症和傳染病。在跟新冠肺炎病毒的對抗中,mRNA疫苗展現出了驚人的力量,這也讓人們看到了希望。也許未來透過mRNA技術,真的能夠開發出預防癌症的疫苗呢!
來源:網路資料
來源:花生時報wwwallother
研究:栗葉中的一種分子可以中和掉耐藥的葡萄球菌
據媒體報導,科學家們從歐洲栗子樹的葉子中提取出了一種分子,它可以中和危險的、耐藥的葡萄球菌。由來自埃默里大學的科學家領導的科研團隊日前將這一成果發表在《Frontiers in Pharmacology》上。研究人員將這種分子命名為Castaneroxy A--以歐洲板栗Castanea命名。
據悉,義大利鄉村傳統偏方中栗葉的使用啟發了這項研究。
這項論文的資深作者、埃默里大學人類健康研究中心和醫學院皮膚病學系副教授Cassandra Quave表示:「我們能夠分離出這種分子,這是科學上的新發現,它只存在於栗葉中且非常少量。我們還展示了它是如何通過破壞耐甲氧西林金黃色葡萄球菌產生毒素的能力來解除其武裝的。」
耐甲氧西林金黃色葡萄球菌(MRSA)由於對抗生素具有耐藥性,進而導致難以治療的感染。它是全球最嚴重的傳染病之一,被美國疾病控制與預防中心(CDC)列為「嚴重威脅」。僅在美國,每年就發生近300萬起耐抗生素感染並導致超3.5萬人死亡。
抗生素通過殺死葡萄球菌發揮作用,而葡萄球菌能讓少數存活下來的細菌產生更大的耐藥性從而產生「超級細菌」。Quave實驗室已經從巴西花椒樹和歐洲栗子樹中鑒定出了可以簡單中和MRSA的有害影響從而讓細胞和組織在不會增加抗力的情況下從感染中自然癒合的化合物。
Quave表示:「我們正在嘗試用跟傳統抗生素作用不同的化合物來填補抗菌藥物研發的管道。我們迫切需要這些新戰略。」她指出,抗生素感染每年導致全球約70萬人死亡,如果沒有新的治療方法,這個數字預計將呈指數級增長。
這項研究的論文第一作者是Akram Salam,他作為博士研究生通過埃默里大學的分子系統和藥理學研究生項目在Quave實驗室進行了這項研究。
Quave是一位醫學民族植物學家,專門研究傳統的植物療法以尋找到有前景的新藥物。盡管許多主要藥物都是植物性藥物,從阿司匹林到紫杉醇,Quave是少數幾個專注於抗生素耐藥性的民族植物學家之一。
這篇論文背後的故事始於十多年前,當時Quave和她的同事研究了書面報告並在義大利南部農村地區進行了數百次實地采訪。這讓他們想到了原產於南歐和小亞細亞的歐洲甜栗樹。「在義大利傳統醫學中,將煮熟的葉子敷在皮膚上可以用來治療燒傷、皮疹和感染的傷口,」Quave說道。
於是Quave把樣本帶回實驗室分析。2015年,她的實驗室發表了一項研究結果,即葉子中的提取物甚至能消除超強毒性的MRSA菌株,這些菌株可能會在健康運動員身上造成嚴重感染。實驗還表明,這種提取物不會干擾皮膚細胞上正常、健康的細菌。
最後,研究人員展示了提取物的工作原理,即通過抑制MRSA細菌彼此交流的能力。據悉,這一過程被稱為群體感應。MRSA利用這種感應信號系統製造毒素並增強其毒性。
在這篇論文中,研究人員希望從植物提取物中分離出這些活性成分。人工提取的過程非常辛苦,因為植物提取物通常會含有數百種不同的化學物質。每一種化學物質都必須被分離出來,然後進行功效測試。大規模的分數收集器加上高性能的液相色譜系統使得分離過程自動化,但它們可能要花費數萬美元並且沒有Quave實驗室需要的所有功能。
不過這一實驗室的研究專家Marco Caputo解決了這個問題。他用了一個兒童玩具的軟體設備、樂高MINDSTORMS創造者,一些樂高積木以及五金店的一些組件為實驗室定製了一個自動液體分離器,成本為500美元。實驗室成員將這項發明稱為LEGO MINDSTORMS Fraction Collector。
之後,Quave實驗室首次從植物提取物中分離出一組分子--環阿爾廷型三萜(cycloartane triterpenoids)並首次顯示出這組分子能有效阻斷MRSA的毒性。然後研究人員深入研究,他們從這組分子中分離出最活躍的單一分子--現被稱為Castaneroxy A。
「我們自製的設備真的幫助加快了我們的發現步伐。我們能夠分離出這種分子並獲得它的純晶體,盡管它只占栗葉的0.0019%,」Quave說道。
科羅拉多大學的共同作者Alexander Horswill的實驗室通過對感染了MRSA的老鼠皮膚展開的測試證實了這種分子在抑制MRSA毒性方面的功效,這使得皮膚癒合得更快。
Quave繼續說道:「我們正在為臨床層面對抗細菌感染的新策略奠定基礎。我們不是過分關注如何治療病原體,而是專注於如何更好地治療病人。我們的目標不是殺死微生物而是找到削弱它們的方法以便免疫系統或抗生素能夠更好地清除感染。」
來源:cnBeta
現代社會太干淨帶來兒童的免疫系統缺陷?並不會
根據倫敦大學洛杉磯分校和倫敦衛生與熱帶醫學學院的研究人員的一項新研究,現代社會太干淨,導致兒童免疫系統缺陷的理論應該被掃地出門。在醫學上,"衛生假說 "指出,兒童早期接觸特定的微生物可以通過促進免疫系統的發展來保護兒童免受過敏性疾病的侵害。然而,有一種普遍的觀點(公眾敘事)認為21世紀的西方社會過於衛生,這意味著幼兒和兒童在生命早期可能較少接觸到細菌,因此對過敏的抵抗力較弱。
在這篇發表在《過敏與臨床免疫學雜誌》上的論文中,研究人員指出了四個重要的原因,他們說,這些原因推翻了這一理論,並得出結論,"太干淨,對我們自己有利"。
主要作者、醫學微生物學名譽教授格雷厄姆-魯克(UCL感染與免疫)說。"在早期生活中接觸微生物對免疫和代謝系統的'教育'至關重要。在我們的內髒、皮膚和呼吸道中的生物體也在維持我們的健康方面發揮著重要作用,直到老年:因此在整個生命中我們需要接觸這些有益的微生物,這些微生物主要來自我們的母親、其他家庭成員和自然環境。但20多年來,公眾一直在談論手部和家庭衛生習慣,這對阻止接觸致病病原體至關重要,但也阻礙了對有益生物體的接觸。在這篇論文中,我們著手調和清潔和衛生的需要,以保持我們沒有病原體,以及需要微生物輸入來填充我們的腸道,建立我們的免疫和代謝系統之間的明顯衝突。"
在對證據的審查中,研究人員指出了四個因素:
首先,在現代家庭中發現的微生物在很大程度上不是我們免疫所需的微生物。
第二,疫苗除了保護我們免受它們所針對的感染外,還對加強我們的免疫系統有很大的作用*,所以我們現在知道,我們不需要冒著死亡的危險去接觸病原體。
第三,我們現在有具體證據表明,自然綠色環境中的微生物對我們的健康特別重要;家庭清潔和衛生對我們接觸自然環境沒有影響。
最後,最近的研究表明,當流行病學家發現家庭清潔與過敏等健康問題之間存在關聯時,這往往不是由清除生物體引起的,而是由於肺部暴露於清潔產品,而清潔產品會造成一種損害,促使過敏反應的發展。
魯克教授補充說:"因此,家庭清潔是好的,個人清潔也是好的,但是,正如論文中詳細解釋的那樣,為了防止感染的傳播,需要針對最經常參與感染傳播的手和表面。通過有針對性的清潔做法,同時也需要限制兒童直接接觸清潔劑的機會。"
"接觸我們的母親、家庭成員、自然環境和疫苗可以提供我們需要的所有微生物輸入。這些接觸與明智的有針對性的衛生或清潔並不衝突"。
來源:cnBeta
研究發現在腦癌患者身上發現的淋巴結狀結構可以幫助對抗腫瘤
烏普薩拉大學的研究人員在腦癌患者身上發現了靠近腫瘤的淋巴結狀結構,免疫細胞可在此被激活以攻擊腫瘤。他們還發現,在一個小鼠模型中,免疫療法增強了這些結構的形成。這一發現為調節免疫系統的抗腫瘤反應提供了新的機會。
膠質瘤是一種致命的腦腫瘤,預後慘淡。腦瘤非常難以治療的一個原因是,我們的免疫系統旨在檢測和摧毀包括癌細胞在內的外來細胞,但由於大腦周圍的障礙物,它不能輕易到達腫瘤部位。
為了對抗發展中的腫瘤,T淋巴細胞等殺傷性免疫細胞必須在體內的淋巴結中被激活和准備好,然後再前往腫瘤部位有效地殺死癌細胞。由於大腦周圍的障礙,T淋巴細胞到達腫瘤是一個具有挑戰性的過程。
在現在發表在《自然通訊》雜誌上的研究中,研究人員描述了他們在大腦中發現的類似於淋巴結的結構,T淋巴細胞可以在那里被激活。
"首次發現膠質瘤患者中存在類似淋巴結的結構是非常令人興奮的。這些結構被稱為三級淋巴結構(TLS),它們在健康人中是不存在的。"免疫學、遺傳學和病理學系的博士生、該研究的第一作者Alessandra Vaccaro說:"它們擁有支持現場淋巴細胞激活所需的所有成分,這意味著它們可能對抗腫瘤免疫反應產生積極影響。"
研究人員還表明,大腦中TLS的形成可以由膠質瘤小鼠的一種免疫療法誘導。事實上,當他們用稱為αCD40的免疫刺激抗體治療小鼠時,TLS的形成得到了加強,並且總是發生在腫瘤附近。
領導這項研究的Anna Dimberg說:"了解到免疫療法可以調節大腦中三級淋巴結構的形成,為尋找調節膠質瘤中抗腫瘤免疫反應的新方法提供了令人興奮的機會。"
αCD40目前正在一些臨床試驗中被用來治療腦腫瘤。在現在發表的研究中,研究人員發現,雖然αCD40促進了TLS的形成,但它也反作用地抑制了T淋巴細胞的腫瘤殺傷能力。因此,該研究對αCD40療法的多方面影響提供了重要的見解。
來源:cnBeta
通過確定免疫療法誘發毒性的機制 科學家為減少副作用的癌症療法鋪平道路
通過確定免疫療法誘發毒性的機制,來自瑞士日內瓦大學(UNIGE)和哈佛醫學院的科學家正在為減少副作用的癌症治療鋪平道路。近年來,免疫療法已經徹底改變了癌症治療的領域。然而,健康組織中的炎症反應經常引發副作用,這些副作用可能很嚴重,並導致治療的永久中止。這種毒性仍然沒有得到很好的理解,是使用免疫療法的一個主要障礙。
來自日內瓦大學和哈佛大學醫學院的科學家們已經成功地確定了有害的免疫反應和那些針對腫瘤細胞的反應之間的區別,這些反應是人們所追求的。他們發現,雖然免疫機制相似,但涉及的細胞群卻不同。
這項發表在《科學免疫學》(Science Immunology)雜誌上的工作使研究人員有可能為癌症患者設想出更有針對性、更有效和更少危險的治療方法。
基於對病人免疫系統的大規模刺激,免疫療法已經拯救了許多生命。不幸的是,它們並非沒有後果。"當免疫系統被如此密集地激活時,由此產生的炎症反應可能會產生有害影響,有時會對健康組織造成重大損害,"UNIGE醫學院病理學和免疫學系及腫瘤血液學轉化研究中心的ISREC基金會腫瘤免疫學主席Mikaël Pittet說,他也是瑞士萊曼癌症中心的成員。
"因此,我們想知道,旨在消除癌症的理想免疫反應和可能影響健康組織的不需要的反應之間是否存在差異。識別這兩種免疫反應之間的獨特元素,確實可以開發出新的、更有效和毒性更小的治療方法"。
科學家們利用在CHUV和HUG接受治療的遭受這種毒性反應的病人的肝臟活檢樣本,研究了起作用的細胞和分子機制,以揭示相似性和不相似性。
類似的反應,但有不同的細胞
在免疫療法相關的毒性反應中,兩種類型的免疫細胞--巨噬細胞和中性粒細胞群--似乎負責攻擊健康組織,但不參與殺死癌細胞。相反,另一種細胞類型--樹突狀細胞群--不參與攻擊健康組織,但對消除癌細胞至關重要。
Mikaël Pittet解釋說:"免疫療法可以觸發專門蛋白質的產生,提醒免疫系統並引發炎症反應。在腫瘤中,這些蛋白質是受歡迎的,因為它們允許免疫系統摧毀癌細胞。然而,在健康組織中,這些同樣的蛋白質的存在可能導致健康細胞的破壞。因此,這些炎症蛋白在腫瘤和健康組織中由如此不同的細胞產生的事實是一個有趣的發現。"
樹突狀細胞非常罕見,而巨噬細胞和中性粒細胞則更為常見。一些巨噬細胞從胚胎發育階段就存在於我們的大多數器官中,並在我們的一生中一直存在。與以前的想法相反,這些巨噬細胞不一定能抑制炎症,但在免疫療法的刺激下,可以在它們所在的健康組織中引發有害的炎症反應,從而解釋了為什麼毒性會影響不同的器官。
當巨噬細胞被藥物激活時,它們會產生炎症性蛋白。這些反過來又激活了中性粒細胞,後者執行毒性反應。"Mikaël Pittet說:「這為通過操縱中性粒細胞限制免疫療法的副作用提供了可能性。」
科學家們通過研究小鼠的免疫反應證實了他們的發現,這些小鼠的細胞活性是用遺傳工具來調節的。他們能夠確定一個可以被利用來消除這些副作用的漏洞。事實上,中性粒細胞產生一些對毒性發展很重要的因素,包括TNF-α,這可能是一個治療目標。TNF-α抑制劑已經被用於調節關節炎患者的免疫反應,也許在癌症治療中也可以用來抑制免疫療法中中性粒細胞的毒性作用。
「此外,抑制中性粒細胞可能是一種更有效的抗癌方式:除了引發毒性反應外,其中一些細胞還促進腫瘤生長。因此,通過設法控制它們,我們可以產生雙重的有益效果:克服健康組織的毒性,並限制癌細胞的生長,」Mikaël Pittet總結道。
來源:cnBeta
矽膠乳房植入物表面如何影響免疫系統?新研究給出答案
據媒體報導,美國每年約有40萬人接受矽膠乳房植入手術。根據美FDA的數據,由於疤痕組織的積累和其他並發症,大多數植入物需要在10年內更換。由麻省理工學院(MIT)研究人員領導的一個團隊現已系統地分析了這些植入物的不同表面結構是如何影響不良反應的發展的,在極少數情況下,可能包括一種不尋常的淋巴瘤。
前MIT博士後Omid Veiseh指出:「植入物的表面形貌可以極大地影響免疫反應對其的感知,這對植入物的設計有重要的影響。我們希望這篇論文能為整形外科醫生評估和更好地理解植入物的選擇如何影響患者的體驗提供基礎。」
研究人員表示,這些發現還可以幫助科學家在未來設計更多的生物相容性植入物。
「我們很高興能帶來新的材料科學方法來更好地理解隆胸領域的生物相容性問題。我們也希望我們所進行的研究將廣泛有助於理解如何設計更安全、更有效的任何類型的植入物,」MIT David H. Koch研究所教授、這項研究的論文資深作者Robert Langer說道。
表面分析
矽膠乳房植入物自20世紀60年代開始使用,最早的版本表面光滑。然而,使用這些植入物,患者經常會經歷一種稱為包膜攣縮的並發症,即在植入物周圍形成疤痕組織並擠壓它並產生疼痛或不適以及可見的植入物變形。這些植入物也可能在植入後翻轉,需要手術調整或移除。
在20世紀80年代末,一些公司開始製造表面粗糙的植入物,希望減少包膜攣縮率並使其更好地跟組織「粘」在一起並固定在原地。他們創造了一個表面,其峰值可以延伸到表面以上數百微米。
然而2019年,FDA要求一家乳房植入物製造商召回所有在美國銷售的高紋理乳房植入物(約80微米),原因是存在跟乳房植入物相關的間變性大細胞淋巴瘤(一種免疫系統癌症)風險。
這是十年前的新一代乳房植入物,擁有獨特的專利表面結構,它不僅包括輕微的表面粗糙度--平均約4微米,還包括其他特定的表面特徵--偏度和數量、分布、接觸點的尺寸優化到細胞尺寸,這些則是為了防止這些並發症。
2015年,Doloff、Veiseh和來自Establishment實驗室的研究人員合作探索了這種獨特的表面及其他常用的表面是如何跟周圍組織和免疫系統相互作用的。他們首先測試了五種市面上出售的植入物,這些植入物具有不同的形貌,包括粗糙度,其中包括之前被召回的高紋理的。其中兩個植入物具有上述的新型表面結構,一個是4微米的粗糙度,另一個是15微米的粗糙度,都由Establishment實驗室製造。
在一項對兔子的研究中,研究人員發現暴露在最粗糙植入物表面的組織顯示出巨噬細胞活性增加的跡象。巨噬細胞是一種通常用來清除外來細胞和碎片的免疫細胞。
所有的植入物都刺激了稱為T細胞的免疫細胞,但方式不同。粗糙表面的植入物刺激了更多的促炎T細胞反應,而具有獨特表面形貌(平均粗糙度為4微米)的植入物刺激了似乎會抑制組織炎症的T細胞。
研究人員的發現表明,粗糙的植入物會跟周圍組織摩擦進而造成更大的刺激。這或許可以解釋為什麼粗糙的植入物會導致淋巴瘤:假設是一些質地脫落並困在附近的組織中,在那里引發慢性炎症,最終可能會導致癌症。
研究人員還在老鼠身上測試了這些植入物的微縮版。他們使用跟製造人體大小的植入物相同的技術製造了這些植入物,結果顯示更具質感的植入物激發了更多的巨噬細胞活性、更多的疤痕組織形成以及更高水平的炎症T細胞。研究人員還對來自這些組織的免疫細胞進行了單細胞RNA測序,以此來確認這些細胞表達了促炎基因。
「雖然完全光滑的表面植入物也有更高水平的巨噬細胞反應和纖維化,但很明顯,在小鼠中,單個細胞受到更大的壓力並在對最高表面粗糙度的反應中表達更多的促炎表型,」Doloff說道。
另一方面,跟具有更高粗糙度或完全光滑表面的種植體相比,具有獨特表面結構的植入物似乎可以顯著減少疤痕和炎症的數量。
「我們相信,這是由於這種存在於身體單個細胞規模的表面結構使得細胞以不同的方式感知它們,」Doloff指出。
喬治華盛頓大學醫學中心放射學教授Rachel Brem是乳房成像和介入的主任,她指出這項研究「調查了乳房重建中最及時和最復雜的問題之一--乳房重建。如何識別免疫反應最小的矽膠乳房植入物以最大限度地降低植入性淋巴瘤的風險。」
「發現復雜的炎症和抗炎反應至關重要,與光滑的植入物相比,4微米紋理植入物的膠囊更薄、更透明,是矽膠乳房植入物的最佳配方,其厚度最小,整體免疫反應最小。這是一個至關重要的發現,它將允許為患者開發最佳的種植體,」Brem說道。據悉,Brem並未參與這項研究。
研發更安全的植入物
在進行了動物實驗之後,研究人員分析了來自MD Anderson的大量癌症組織樣本,進而對人類患者對不同類型矽膠乳房植入物的反應展開研究。
在這些樣本中,研究人員發現了跟他們在動物研究中看到的相同類型的免疫反應的證據。在他們的發現中,他們觀察到,多年來被高度紋理植入物宿主的組織樣本顯示出慢性、長期免疫反應的跡象。他們還發現,植入高質地植入物的患者的疤痕組織更厚。
Veiseh說道:「在老鼠、兔子和人類(組織樣本)中進行全面的比較確實提供了說明這些樣本之間如何相互比較的更有力和實質性證據。」
研究人員們希望他們的數據集可以幫助其他研究人員優化矽膠乳房植入物和其他類型的醫用矽膠植入物的設計以獲得更好的安全性。
來源:cnBeta
由大米製成的可食用霍亂疫苗在一期人體試驗中被證明是安全的
據媒體報導,一種防止致命霍亂的新疫苗是通過研磨轉基因大米製成的。第一次人體試驗顯示沒有明顯的副作用,並且有良好的免疫反應。位於東京大學和千葉大學的研究人員在《柳葉刀微生物》雜誌上發表了這種名為MucoRice-CTB的疫苗的第一期臨床試驗的同行評審結果。
在COVID-19的刺激下,疫苗製造在2020年取得了巨大的進步。然而,基於mRNA的SARS-CoV-2疫苗的復雜性突出了可以廉價製造、運輸和儲存且無需冷藏的接種疫苗的價值。MucoRice-CTB疫苗在室溫下自始至終都是穩定的。
「我對我們的MucoRice-CTB疫苗的未來非常樂觀,特別是因為劑量升級的結果。」領導MucoRice項目的東京大學醫學科學研究所博士、博士生導師Hiroshi Kiyono教授說:「參與者對低、中、高劑量的疫苗都有反應,其中最高劑量的免疫反應最大。」Hiroshi Kiyono博士也是日本千葉大學和美國加州大學聖迭戈分校的教職員工。
30名志願者接受了安慰劑,10名志願者組成的小組接受了總共四次劑量,每兩周一次,每次3毫克、6毫克或18毫克的疫苗。在接受最後一劑疫苗2個月和4個月後的測試顯示,對疫苗有反應的志願者有IgA和IgG抗體--免疫系統為對抗感染而產生的兩種類型的蛋白質--對霍亂毒素B(CTB)有特異性。接受更高劑量疫苗的參與者更有可能產生CTB特異性抗體。
一個獨立審查委員會沒有發現明顯副作用的證據。
霍亂弧菌是人類霍亂的病原體,最常通過被污水污染的飲用水傳播。如果沒有醫療照顧,霍亂患者可以在短短幾小時內因腹瀉和嚴重脫水而死亡。據世界衛生組織稱,霍亂感染了130萬至400萬人,每年造成21000至14.3萬人死亡。
有四種現代的無針霍亂疫苗,所有這些疫苗都是以口服方式給藥,但需要冷藏,而且是由整個殺死的霍亂細胞或減弱的霍亂活細胞製成。
新型霍亂疫苗生長在經過基因改造的日本短粒水稻植株中,這些植物產生的CTB的無毒部分可以被免疫系統識別。CTB在結構上與某些類型的致病大腸桿菌製造的毒素相似,因此霍亂疫苗常常對旅行者的腹瀉提供交叉保護。
研究人員在一個專門建造的室內水培農場中種植水稻植物,該農場符合世衛組織藥品良好生產規范標準,這確保了疫苗不受污染,植物與自然環境隔離。
這些植物在其種子中產生CTB亞單位,即大米的可食用顆粒,並將抗原儲存在稱為蛋白體的液滴中,其膜由脂肪製成。Hiroshi Kiyono博士說:「大米蛋白體的行為就像一個天然膠囊,將抗原送到腸道免疫系統中。」
其他藥物已經在植物中生長,最常見的是葉子--包括治療伊波拉病毒、淋巴瘤和流感的藥物--但這些藥物在使用前必須被提取和純化。MucoRice系統以穀物為基礎,避免了這些額外的步驟,也不需要冷藏,並在抗原通過胃部的強酸時保護它們。
當植物成熟時,大米被收割並磨成細粉,然後密封在鋁包中儲存。當人們准備好接受疫苗接種時,將粉末與大約90毫升的液體混合,然後飲用。研究人員只用生理鹽水(一種相當於體液的鹽溶液)對疫苗進行了測試,但他們預計用白開水也會有同樣的效果。
Hiroshi Kiyono博士說:「我們的疫苗的美麗之處在於,它明智地利用身體的黏膜免疫系統,通過腸道誘導抗原特異性抗體。」
MucoRice-CTB通過腸道黏膜進入人體,模擬了一種遇到病菌並對其作出反應的自然方式。刺激黏膜免疫系統會產生兩類抗體,即IgG和IgA,它們能識別病菌並將其作為清除的目標。在皮膚下或肌肉中注射的疫苗通常只增加IgG抗體,而不是IgA抗體。
對MucoRice-CTB有反應的志願者在8至16周後血液中的抗原特異性IgG和IgA水平最高。
然而,在接受疫苗的30名志願者中,有11名志願者顯示出較低或沒有可測量的免疫反應。所有研究志願者都報告說從未在日本以外的地方旅行,因此他們以前不太可能接觸到霍亂病毒或致病性大腸桿菌,也不可能有自然免疫力。
Kiyono博士回憶說:「當我們看到這些關於11個低反應者和無反應者的數據時,我們認為也許腸道微生物對免疫反應的結果有影響。」
微生物群或微生物組是生活在我們體內的微生物群落,它們要麼對我們有益,要麼無害。消化系統的微生物群影響健康和免疫力是公認的,但科學家們剛剛開始了解這種關系的確切機制。
對所有志願者的糞便樣本進行廣泛的基因分析後,研究人員確定了生活在志願者腸道中的數千個細菌物種。
Kiyono博士說:「簡單來說,高反應者的微生物群更加多樣化,而在低反應者群體中,多樣性更缺乏。」
研究人員提醒說,第一階段研究的規模較小--只給30名健康的日本男性志願者接種疫苗--意味著無反應者的相關性和流行率仍不清楚,而且微生態多樣性的總差異是微妙的。然而,這些結果確實暗示了微生物菌群在疫苗有效性方面的更大作用。
Kiyono博士說:「現在都是猜測,但也許更高的微生物多樣性為對口服疫苗的強烈免疫反應創造了一個更好的條件。」
來源:cnBeta