Tag: 蛋白質
Cygames宣布向醫學研究機構捐款研究一項可以延長貓生命的蛋白質
周一Cygames在Twitter上宣布已經向AIM醫學研究所捐款,該研究所正在致力於AIM蛋白質的研究機構,該蛋白質據說可以有效延長貓的平均壽命。
AIM(巨噬細胞凋亡抑制劑的縮寫)是在巨噬細胞中發現的一種蛋白質。這種蛋白質已被證明在治療腎髒疾病方面很有用,許多家貓在年老時會患上這種疾病。如果在幼年時服用,一劑功能正常的AIM據說可以減少貓患腎病的幾率,可能使貓的平均壽命延長一倍。
研究小組負責人宮崎駿(Toru Miyazaki)一直在致力於開發一種針對貓的AIM藥物,但由於資金困難,他被迫暫停了研究。有鑒於此,Cygames決定為該研究提供持續的捐贈支持,直到該藥物實現實際應用。
宮崎徹評論道:「在與醫藥和制藥完全不同的領域,公司的支持是對我們的極大鼓勵。」。「我們將利用這筆捐款,以及我們從公眾那里收到的許多其他捐款,大大加快我們對AIM的研究。我們所有的研究人員將盡最大努力盡快完成AIM藥物。」
Cygames高級董事總經理木村忠人(Tadato Kimura)也對此次捐贈發表了評論:「據說日本現在有近1000萬只貓,對許多貓主人來說,貓是不可替代的伴侶,豐富了他們的生活,給他們帶來了歡樂。我們很高興我們的捐贈將幫助他們治癒伴侶的不治之症,拯救許多生命。」
來源:和邪社
研究:將藻類蛋白質包裹在液滴中可使人工光合作用的效率提高三倍
據媒體New Atlas報導,「重現」光合作用的過程,即植物自然地將陽光、水和二氧化碳轉化為化學能,為其生存提供動力,是可再生能源研究的一個關鍵目標,而新加坡南洋理工大學的一項新研究可以幫助這些努力。該校的科學家已經證明了將藻類蛋白質包裹在小水滴中可以將其自然能量採集能力提高三倍,標志著該技術向商業可行性又邁進了一步。
從事人工光合作用的科學家所面臨的挑戰之一是迄今為止所開發的解決方案的效率相對較低。據新加坡南洋理工大學的團隊說,太陽能電池板通常以20%左右的效率將太陽光轉化為能量,而目前的人工光合作用技術的效率大約為4%或5%。
這項研究的負責人陳宇成副教授說:「人工光合作用的效率不如太陽能電池。然而,它是更可再生和可持續的。由於人們對環境友好和可再生技術的興趣越來越大,從海藻中的光收集蛋白中提取能量已經引起了生物能源領域的極大興趣。」
陳宇成在研究中所使用的蛋白質被稱為藻膽蛋白,它們負責吸收藻類細胞內的光,並在整個光譜范圍內進行吸收。科學家們著手提高其將捕獲的光轉化為能量的能力,他們的突破性方法涉及將紅藻封裝在僅20至40微米大小的微小液晶液滴中。
當光線照射到液滴上時,其彎曲的邊緣會誘發研究人員所謂的「回音壁模式」,在這種模式下,光線會繞過周邊,並有效地在液滴內滯留更長時間。更多的光被困在里面的時間意味著有更多的機會發生光合作用。然後,產生的電子可以在電極的幫助下被捕獲。
陳宇成說:「液滴的行為就像一個共振器,限制了大量的光。這給了藻類更多的光照,增加了光合作用的速度。通過在液滴外部塗抹藻類蛋白也可以獲得類似的結果。通過利用微液滴作為光收集生物材料的載體,強大的局部電場增強和液滴內的光子封閉導致發電量大大增加。」
據陳宇成說,與未經處理的藻類蛋白相比,該團隊的液滴處理使發電量增加了兩到三倍。在該團隊尋求擴大技術規模的過程中,對他們有利的是,液滴可以大量生產,而且成本低。這些液滴甚至可以以更大的形式生產,以包裹生長在水體中的藻類,而這些藻類又可以作為漂浮的發電裝置。
陳宇成說:「我們實驗中使用的微型液滴有可能擴大到更大的液滴,然後可以在實驗室環境之外應用於水藻以創造能源。雖然有些人可能認為藻類的生長是不受歡迎的,但它們在環境中發揮著非常重要的作用。我們的發現表明,有一種方法可以將一些可能被視為『生物垃圾』的東西轉化為生物能源。」
另一種可能性在於利用這種技術來提高有機太陽能電池的性能。早在2017年,科學家們就曾展示了納入一種叫做矽藻的藻類如何提高太陽能電池的效率,通過捕獲和散射光線來更有效地收集。
通過這種方式,這項新研究不僅發現了一種可以改善人工光合作用的新機制,而且進一步增加了對生物材料如何與光互動的理解,以及如何利用這種知識來追求清潔能源。
該研究發表在《ACS應用材料與界面》雜誌上。
來源:cnBeta
研究表明被認為是阿爾茨海默病病因之一的有毒蛋白質或源自肝臟
一項令人印象深刻的新研究提出了強有力的證據,表明被認為是阿爾茨海默病病因之一的有毒蛋白質可能在肝臟中產生,並通過血液傳播,然後進入大腦造成神經元損傷。幾十年來,人們普遍認為阿爾茨海默病是由澱粉樣蛋白在大腦中的積累引起的。這些蛋白質形成的有毒聚集物被稱為斑塊,正是這些斑塊損害了大腦。 盡管人們對「澱粉樣蛋白假說」的真實性越來越懷疑,但這些斑塊的堆積仍然是阿爾茨海默病最突出的生理跡象。其中一個更有趣的假設表明,這些破壞性的澱粉樣蛋白起源於肝臟。
調查這種肝臟-澱粉樣蛋白假說的巨大挑戰是,澱粉樣蛋白也在大腦中產生。大多數用於阿爾茨海默病研究的小鼠模型涉及工程動物,以在中樞神經系統中過度表達澱粉樣蛋白的產生,這只真正類似於少數患有家族性早發性阿爾茨海默病的人類。絕大多數患上這種疾病的人反而經歷了所謂的散發性遲發性阿爾茨海默病,即在老年時發病,沒有家族或遺傳病史。
這項新研究的突破在於開發了一種新的阿爾茨海默病動物模型。在這里,研究人員設計了一隻小鼠,使其僅在肝臟中產生人類澱粉樣蛋白,這使得他們能夠對這些蛋白如何進入血液並到達大腦進行新的觀察。
來自澳大利亞科廷大學的該項目的首席研究員John Mamo說,這項新研究提供了 「血液到大腦途徑」的明確證據。利用新開發的小鼠模型,該研究顯示了在肝臟中產生的澱粉樣蛋白如何能夠移動到大腦中並造成損害,導致與阿爾茨海默病類似的病理徵兆。
「正如我們預測的那樣,這項研究發現,在肝臟中產生脂蛋白-澱粉樣蛋白的小鼠模型在大腦中遭受炎症,加速腦細胞死亡和記憶喪失,」Mamo說。「這種『血液到大腦的途徑』意義重大,因為如果我們能夠管理血液中脂蛋白-澱粉樣蛋白的水平,並防止它們滲入大腦,這就為預防阿爾茨海默病和減緩記憶喪失開辟了潛在的新療法。」
Mamo已經在推進基於這種肝臟-澱粉樣蛋白假說的人體臨床試驗。之前的研究表明,一種用於管理高膽固醇的前期藥物,即所謂的普羅布考(probucol),可以抑制肝臟中澱粉樣蛋白的產生。
該臨床試驗於今年開始,計劃招募約300名患有輕度阿爾茨海默病相關痴呆症的受試者。主要結果將是調查每日劑量的普羅布考在兩年內是否會導致認知能力下降的臨床顯著減緩。
但是,如果這種肝臟-澱粉樣蛋白假說在未來的研究中得到進一步驗證,可能會出現一些其他結果。通過評估個人在肝臟中合成澱粉樣蛋白的傾向,可以在年輕時估計阿爾茨海默病的風險。此外,假設可以通過飲食干預來改善肝臟健康並降低一個人患阿爾茨海默病的風險。
Mamo表示:「雖然現在需要進一步的研究,但這一發現表明,這些有毒蛋白質在血液中的大量沉積有可能通過一個人的飲食和一些可以專門針對脂蛋白澱粉樣蛋白的藥物來解決,從而降低他們的風險或減緩阿爾茨海默病的發展。」
這項新研究發表在《PLOS生物學》雜誌上。
來源:cnBeta
「迷你」CRISPR工具:對非活性蛋白質改良以更好進行基因編輯
據媒體報導,CRISPR基因編輯系統通常跟Cas9蛋白相關,但這並不是唯一的選擇。史丹福大學的科學家現在開發了一種名為CasMINI的CRISPR工具,其使用了一種更小的蛋白質,它應該能更容易地進入人類細胞。 CRISPR是一項在活細胞中進行精確基因編輯的強大技術。該工具使用酶來切斷目標DNA序列--如那些跟疾病有關的序列-並使用更有用的東西替換它們。在過去十年左右的時間里,這種方法在治療廣泛的遺傳疾病、改良作物和牲畜、控制害蟲或控制微生物方面顯示出了令人難以置信的前景。
最常用的酶是Cas9,但其他酶如Cas12a、Cas12b、Cas3和CasX也顯示出前景。問題是,它們的效率在某種程度上受到了它們相對較大的尺寸的限制,這使得機器更難擠進細胞並開始工作。因此,在這項新研究中,史丹福大學的研究小組著手設計一個微型CRISPR系統。
該團隊的新型CasMINI僅由529個胺基酸組成,比其他Cas酶的一半還小,後者通常含有1000到1500個胺基酸。即使是之前最小的CasX,仍有近1000個。
當然,如果您的新系統不能正常工作,那麼大小就不重要了。但當該團隊在實驗室對哺乳動物細胞進行測試時,發現它在刪除、激活和編輯DNA方面跟其他Cas酶一樣有效並且更容易進入細胞。
但也許關於CasMINI最令人印象深刻的是,它是從一種叫做Cas12f的不起作用的天然蛋白質中改良而來的。這是製造更小CRISPR酶的一個有趣的起點,因為它只有400到700個胺基酸,但之前的測試顯示在人類細胞中沒有活性。這是最有可能的,因為它起源於被稱為古生菌的微生物,這種微生物的基因組比人類簡單得多。
因此,史丹福大學的研究小組檢查了這種酶的結構並檢查了40種不同的突變,據悉,這些突變可以使它在保持小體積的同時更有效。果然,經過幾年的疊代,他們最終得到了一個運行良好的版本。
研究小組表示,這一進展不僅有助於提高CRISPR的有效性還可能導致縮小RNA系統的新方法如用於開發COVID-19 mRNA疫苗的方法。
來源:cnBeta
研究人員研究廣泛存在於自然界的細菌內部毛發狀蛋白質
來自耶魯大學的研究人員對細菌內部的一種蛋白質進行了研究,這種蛋白質被描述為像頭發一樣,充當了一種被稱為自然界"電網"的開關。研究人員說,整個世界的地球表面下的地面是由覆蓋著這些毛發狀蛋白質的細菌所組成的電氣線路。
這些細菌和它們的蛋白質滲透到所有無氧土壤和深海床,在這項研究之前,這些細菌毛發並不為人所知。它們被描述為控制地球自然電網的開關。
地球上大多數各種形狀和大小的生物都需要呼吸氧氣。然而,一些細菌生活在無法獲得氧氣的地方,導致它們進化出一種被研究人員描述為"呼吸礦物"的生活方式。它們能夠利用其被稱為納米線的極小的蛋白質絲來呼吸這些礦物質。以前,科學家們認為這些納米線是由一種叫做pili的蛋白質組成的,pili在拉丁語中是頭發的意思。
然而,隨後在2019年和2020年發表的研究表明,這些納米線是由完全不同的蛋白質組成。這一發現使人們對以前調查纖毛的大量工作產生了懷疑,於是耶魯大學的研究人員使用低溫電子顯微鏡深入調查纖毛結構,發現它是由兩種蛋白質組成。
纖毛隱藏在細菌內部,像活塞一樣將納米線推向環境中,該研究標志著這種結構首次被揭示。研究人員認為,了解納米線結構將允許對細菌進行裁剪,以實現從對抗疾病和感染到構建活體電路的無數功能。這一突破也可能帶來利用細菌來發電的能力。
來源:cnBeta
科學家確定驅動癌症干細胞的蛋白質 或為膠質母細胞瘤患者提供有效療法
據媒體報導,膠質母細胞瘤是一種侵襲性的腦癌,治療後復發的可能性很高,「休眠」的腫瘤細胞會重新活躍起來並產生新的腫瘤,這使威脅更加嚴重。現在加拿大麥吉爾大學的研究人員確定了驅動癌症干細胞的蛋白質。結合放射治療,靶向和抑制一種名為 galectin1 的特定蛋白質可以為膠質母細胞瘤患者提供更有效的療法。 ...
科學家開發出利用人類蛋白質向細胞運送RNA分子藥物的方法
據媒體報導,來自MIT、MIT麥戈文腦研究所、霍華德·休斯醫學研究所、MIT和哈佛大學的布羅德研究所的研究人員已經開發出一種將分子療法傳遞到細胞上的新方法。這個名為SEND的系統可以通過編程來封裝和運送不同的RNA貨物。
SEND利用體內形成病毒樣顆粒並結合RNA的天然蛋白質,跟其他傳遞方法相比,它可能會引起較少的免疫反應。
新的給藥平台在細胞模型中有效工作,並且隨著進一步的發展可能會為廣泛的分子藥物開辟一類新的給藥方法,其中包括基因編輯和基因替換。現有的這些療法載體可能效率低下並隨機地整合到細胞基因組中,有些還會刺激不必要的免疫反應。SEND有希望克服這些限制,而這可能為部署分子醫學提供新的機會。
「生物醫學界一直在開發強大的分子療法,但以精確和有效的方式將它們傳遞到細胞中是具有挑戰性的,」CRISPR的先驅、該研究的論文資深作者、布羅德研究所核心成員、麥戈文研究所的研究員Feng Zhang說道,「SEND有潛力克服這些挑戰。」
在《科學》的文章中,該團隊描述了SEND(用於細胞遞送的選擇性內源性細胞封裝)如何利用人類細胞製造的分子。在SEND的中心是一種叫做PEG10的蛋白質,它通常會跟自己的mRNA結合並在其周圍形成一個球形的保護囊。在研究中,團隊對PEG10進行了工程改造以選擇性地包裝和傳遞其他RNA。科學家們使用SEND將CRISPR-Cas9基因編輯系統傳送到小鼠和人類細胞中以達到編輯目標基因的目的。
這項研究的論文第一作者Michael Segel是Zhang實驗室的博士後研究員,第二作者Blake Lash是該實驗室的一名研究生,他們稱PEG10在轉移RNA的能力上並不是獨一無二的。「這就是令人興奮的地方,」Segel說道,「這項研究表明,人體內可能還有其他RNA轉移系統也可用於治療目的。這還提出了一些非常有趣的問題,即這些蛋白質的自然作用可能是什麼。」
靈感來自內部
PEG10蛋白自然存在於人類體內,由一種「逆轉錄轉座子(一種類似病毒的基因元素)」衍生而來,這種基因在數百萬年前就與人類祖先的基因組整合在了一起。隨著時間的推移,PEG10已經被機體吸收成為對生命重要的蛋白質庫的一部分。
四年前,研究人員發現另一種反轉錄轉座子衍生的蛋白質ARC也可以形成病毒樣結構並參與細胞之間的RNA轉移。盡管這些研究表明有可能將逆轉錄轉座子蛋白作為轉運平台,但科學家還沒有成功地利用這些蛋白在哺乳動物細胞中包裝和運送特定的RNA。
知道一些反轉錄轉座子衍生的蛋白質能夠結合和包裝分子貨物後,Zhang博士的團隊轉向這些蛋白質作為可能的運輸工具。他們在人類基因組中系統地搜索這些蛋白質並尋找能形成保護性膠囊的蛋白質。在最初的分析中,該團隊發現了48個編碼蛋白質的人類基因,這些蛋白質可能具有這種能力。其中有19種候選蛋白同時存在於小鼠和人類體內。在研究小組的細胞系中,PEG10作為一種高效穿梭細胞脫穎而出;這些細胞釋放的PEG10顆粒則明顯多於其他測試的蛋白質。PEG10粒子也大多含有自己的mRNA,這表明PEG10也可能能夠包裝特定的RNA分子。
開發模塊化系統
為了開發SEND技術,該團隊確定了PEG10 mRNA中的分子序列或稱「信號」,PEG10可識別並用於包裝其mRNA。然後,研究人員利用這些信號來改造PEG10和其他RNA貨物從而使PEG10可以選擇性地包裝這些RNA。接下來,研究小組利用額外的蛋白質裝飾PEG10膠囊,這些蛋白質被稱為「融合原(fusogens)」,它們在細胞表面被發現並可以幫助細胞融合在一起。
通過在PEG10膠囊上設計融合原,研究人員應該能將膠囊靶向到一種特定的細胞、組織或器官。作為實現這一目標的第一步,該團隊使用了兩種不同的融合原--包括在人體中發現的一種--來實現SEND貨物的運送。
Zhang指出:「通過混合和匹配SEND系統中的不同成分,我們相信它將為開發不同疾病的治療方法提供一個模塊化平台。」
發展基因療法
SEND是由體內自然產生的蛋白質組成的,這意味著它可能不會觸發免疫反應。研究人員指出,如果這在進一步的研究中得到證實,那麼SEND可能會為重復使用基因療法提供機會,並且副作用還很小。Lash說道:「SEND技術將補充病毒載體和脂質納米顆粒,這進一步擴大將基因和編輯療法傳遞到細胞的方法工具箱。」
接下來,該團隊將在動物身上測試SEND並進一步設計該系統從而將貨物運送到各種組織和細胞。他們還將繼續探索人體中這些系統的自然多樣性以確定可以添加到SEND平台的其他組件。
來源:cnBeta
新發現的遺傳「開關」:蛋白質通過DNA「交流」 進行遠距離「對話」
據魏茲曼科學研究所的研究人員說,蛋白質可以通過DNA進行「交流」,進行遠距離「對話」,作為一種遺傳「開關」。他們發現,蛋白質與DNA分子的一個位點結合,可以對遠處的另一個結合位點產生物理影響,而這種「同群效應」可以激活某些基因。這種效應以前曾在人工系統中觀察到過,但魏茲曼的研究首次表明它發生在生物體的DNA中。
由化學和結構生物學系的Hagen Hofmann博士領導的團隊在研究土壤細菌枯草芽孢桿菌中的一個奇特現象時做出了這個發現。這些細菌中的一小部分表現出一種獨特的技能:通過吸收散落在它們周圍土壤中的細菌基因片段來豐富它們的基因組的能力。這種能力取決於一種叫做ComK的蛋白質,這是一種轉錄因子,它與DNA結合以激活使清掃成為可能的基因。然而,人們不知道這種激活究竟是如何進行的。
科學家Gabriel Rosenblum博士領導了這項研究,研究人員利用先進的生物物理工具--單分子FRET和低溫電子顯微鏡探索了細菌的DNA。特別是,他們集中研究了ComK蛋白結合的DNA分子上的兩個位點。
他們發現,當兩個ComK分子與其中一個位點結合時,會產生一個信號,促進另外兩個ComK分子在第二個位點結合。信號可以在這些位點之間傳播,因為原始蛋白的結合所引發的物理變化會產生張力,沿著DNA傳遞,就像從一端扭動繩子一樣。一旦所有四個分子都與DNA結合,就會通過一個閾值,開啟該細菌的基因清除能力。
Rosenblum說:「我們驚訝地發現,DNA除了包含遺傳密碼外,還像一條通信電纜,在相對較長的距離內將信息從一個蛋白質結合點傳輸到另一個結合點。」
通過操縱細菌的DNA並監測這些操縱的效果,科學家們澄清了DNA內「長距離通信」的細節。他們發現,為了使兩個位點之間的「通信」或「合作」發生,這些位點必須位於彼此之間的特定距離,並且它們必須在DNA螺旋結構上面向同一方向。對這兩個條件的任何偏離--例如,增加距離--都會削弱通信。人們發現在兩個站點之間運行的遺傳字母序列對這種通訊沒有什麼影響,而DNA的斷裂則完全中斷了這種通訊,這進一步證明了這種通訊是通過物理連接發生的。
了解這些細節可能有助於為各種應用設計所需強度的分子開關。後者可能包括對細菌進行基因工程以清理環境污染或合成可用作藥物的酶。
Hofmann說:「DNA分子內的長距離通信是一種新型的調節機制--它為設計未來的基因電路開辟了以前無法獲得的方法。」
來源:cnBeta
人類蛋白質使研究人員能夠直接向細胞提供藥物治療
麻省理工學院和其他機構的研究人員創建了一個基於人類蛋白質的可編程系統,可將基因編輯和分子治療劑直接送入細胞。研究人員開發的系統被稱為SEND,它可以通過編程將各種RNA貨物直接封裝並輸送到細胞中。SEND利用在人體中發現的天然蛋白質,形成類似於病毒的顆粒結合RNA。
通過利用人體中自然存在的蛋白質,該方法產生的免疫反應比類似的傳遞系統更少。研究人員發現該遞送系統在細胞模型中有效地工作,他們認為進一步的開發可能會產生一類新的遞送方法,用於一系列的分子藥物,例如,該系統可用於基因編輯或替換。
雖然現在已經有類似的基因編輯和替換的傳遞平台,但它們相比新技術而言是低效的。現有系統的一個很大的缺點是它們隨機地整合到細胞的基因組中,這樣會刺激免疫反應。SEND可以克服圍繞目前的傳輸系統的問題。
SEND的核心成分之一是PEG10蛋白,它在人體中與自身的mRNA結合,在其周圍形成一個保護囊。在這項研究中,研究人員設計了PEG10包裝,以傳遞其他RNA。他們能夠將CRISPR-Cas9基因編輯系統送入小鼠和人類細胞。一旦進入細胞,該編輯系統就能夠編輯目標基因。
研究人員在研究中指出,在人體中可能還有其他RNA傳輸系統,也可以用於治療目的。這項研究中所利用的蛋白質,即PEG10,自然存在於人體中,來自於數百萬年前整合到我們祖先體內的一種類似病毒的基因元素。
來源:cnBeta
蛋白質和炎症:對成人失明的主要原因的研究迎來突破
包括倫敦大學瑪麗皇后學院研究人員在內的一個科學家小組發現,最常見的成人失明形式可能是由五種蛋白質中至少一種調節免疫系統的失敗造成的。這些發現有朝一日可能預示著對發展中的老年性黃斑變性(AMD)的變革性治療的發展,僅在英國就有60萬人受到這一疾病影響。
一種確定哪些患者有患病風險的測試也可能出現,因為研究小組估計40-50%的患者至少有五種蛋白質中的一種水平升高,盡管仍有更多工作要做。
這項研究由醫學研究委員會資助,由倫敦、曼徹斯特和德國圖賓根的科學家合作完成,今天發表在《美國人類遺傳學雜誌》上。
科學家們早就知道,眼部炎症在老年性黃斑變性的發展中起了作用。在以前的研究中,一系列被認為是調節我們對病原體的免疫防禦的基因被確定為影響一個人發展該疾病風險的候選基因。
然而,直到現在,這些基因:補體因子H(CFR)和補體因子H相關的1至5(CFHR-1至CFHR-5)的作用還不清楚。
但是,通過研究604份血漿樣本中這些基因產物的水平,研究小組能夠首次顯示,所有五個FHR蛋白在AMD患者中的水平都高於非患者。
作為先天免疫系統的一部分,補體途徑是我們抵禦感染的第一道防線,並通過標記它們進行破壞,招募和激活其他免疫細胞來清除受損細胞。在AMD病程中,補體途徑在眼部被過度激活,促進了不適當的和破壞性的炎症反應。
領導數據分析的瑪麗皇后學院威廉·哈維研究所統計基因組學講師Valentina Cipriani博士說:"15年多來,AMD的重點一直是補體因子H及其蛋白質FH。我們的分析清楚地指向了FH之外。通過使用一種被稱為全基因組關聯研究的方法,觀察患有和不患有該疾病的人的基因組中的遺傳變異,我們能夠確定決定較高FHR蛋白水平和AMD風險增加的遺傳變異。"
曼徹斯特大學Stoller生物標志物發現中心的Richard Unwin博士說:"這對AMD患者來說是一項極為重要的研究。在過去幾年里,測量這些FHR蛋白的水平一直是一個很大的挑戰,而且在技術上也相當具有挑戰性,因為它們在血液中的含量很低,而且彼此之間非常相似。通過使用最先進的質譜方法,我們現在可以自信地測量這些蛋白質,並首次表明什麼是AMD如何發展的一個重要因素,如果不是最重要的話。必須強調的是,在我們能夠權威地說這些蛋白質能夠預測風險之前,還需要進行長期的研究--這將需要時間。"
來源:cnBeta
研究:未來的蛋白質可能來自太陽能驅動的微生物生產
據媒體報導,對環境的關注推動了一個新行業的形成,該行業專注於傳統作物和牲畜的綠色替代品,包括植物「肉」。隨著以植物為基礎的肉類替代產業成為主流,研究人員繼續調查新的潛在方式來養活世界上不斷增長的人口......而事實證明,微生物可能發揮著重要作用。
微生物對人類健康至關重要,同樣,它們在我們的食品供應中也長期發揮著作用。許多常見的食物是發酵的,包括奶酪和啤酒,這些都是由有益的微生物實現的。這些同樣的微生物能夠產生蛋白質和其他營養物質,有一天可能成為人類飲食的主食。
哥廷根大學的研究人員探索了這種潛力,並在《美國科學院院報》(PNAS)上發表的一項新研究中報告了他們的發現。據該團隊稱,太陽能電池板是使微生物蛋白質更有效和更環保的關鍵,從而導致一種潛在的可持續的低影響的方式來養活世界人口。
這項研究涉及創建大規模的基於微生物的蛋白質生產設施的模型。這些模型涉及利用空氣、水、營養物質和太陽能來生長微生物的設施,然後將其收割並加工成可食用的營養豐富的蛋白質。
對多種生長策略和不同類型的微生物進行了評估,並與最有效的作物植物--大豆進行了比較。與大豆相比,該研究指出,由微生物生產的一公斤蛋白質只需要10%的土地面積,同時也將所需的肥料和水的數量降到最低。
研究人員表示,基於微生物的蛋白質也可以在北方氣候較冷、日照較少的地方生產,這意味著這些設施有可能建立在無法種植傳統作物的地方--比如說在沙漠中。
據該研究的第一作者Dorian Leger說,微生物蛋白包括所有正常健康所必需的胺基酸,此外還有礦物質和維生素。這使得微生物蛋白成為一種高質量的蛋白質來源,它可以在許多地方生產和收獲,同時有助於保護環境。
來源:cnBeta
研究發現太陽能蛋白質的巨大發展潛力
據媒體報導,讓人感到可悲的是,農業不是最有效的過程,它需要大量的土地和資源,並且隨著人口的增長,我們的糧食供應將要面臨越來越大的壓力。不過現在一項新研究表明,通過微生物養殖蛋白質可能是一種更可持續、更有效的系統。
當前的糧食系統以種植農作物為中心,這需要大量的自然資源如水、陽光、二氧化碳、氮,當然還有土地。其中大部分農產品直接供人類食用,但其中一些會先被輸送到另一個環節--動物,而動物再繼續為人類提供食物之前也需要土地和水。
不過現在,科學家們可以添加一種新的食物來源來讓整個過程變得更有效率--微生物。利用同樣的資源,微生物可以被培育出一種生物質,這種生物質可以被加工成一種富含蛋白質和其他營養物質的可食用粉末。它們可以用來餵養牲畜或製成供人類食用的食物,這樣就能減少對植物作物的需求。
該研究的論文第一作者Dorian Leger表示:「我們預計微生物蛋白作為我們飲食的補充也會有益,因為它提供了由所有必需胺基酸、維生素和礦物質組成的高質量蛋白質來源。這項技術有潛力支持糧食生產, 並與此同時能防止對環境的破壞。目前的耕作方式導致了全球生態系統的污染和水資源的枯竭。」
不過實現它實際嗎?在這項新研究中,一個由來自哥廷根大學的科學家領導的團隊模擬了大規模微生物食品生產設施,他們分析了生產過程中每個步驟的能量需求並調查了不同的微生物設置和類型。
這些模型設施將能利用可再生能源。從外部空氣中捕獲二氧化碳,然後利用太陽能電池提供的電力在生物反應器中將其轉化為微生物的食物。它們反過來會產生可以加工成食物的生物質。
研究小組發現,每公斤微生物蛋白的生產只需要最高效大豆種植的10%的土地。另外,用水量也減少了,對肥料的需求則完全消除掉了。
微生物農場還可以利用不適合傳統農業的地區比如沙漠。模型甚至表明,該系統在沒有充足陽光的高緯度地區仍足夠有效。
當然,這種蛋白粉並不是所有作物的合適替代品--研究小組指出,像甜菜這樣的作物通常不是直接食用的,而是用於食品工業的其他用途。但微生物蛋白可以減少對大豆和穀物等牲畜飼料的需求(以及對環境的影響)。
它不太可能是解決食品安全問題的靈丹妙藥,但微生物蛋白可能只是我們未來飲食中需要做出的眾多調整之一。
來源:cnBeta
蛋白質的”沉默代碼”影響著細胞運動方式 擴展對遺傳代碼的理解
賓夕法尼亞大學領導的一項研究表明,盡管具有幾乎相同的胺基酸序列,但由於其不同的核苷酸序列,兩種形式的蛋白質肌動蛋白在功能上有所不同。蛋白質肌動蛋白是無處不在的,對生命至關重要。在哺乳動物中,每個細胞都表達它的兩種形式:β-肌動蛋白和γ-非肌動蛋白。盡管有不同的作用,但這兩種形式幾乎是相同的,共享其99%的胺基酸序列。
賓夕法尼亞大學獸醫學院的Anna Kashina及其同事的研究表明,與之前的認識相反,支配這些蛋白質在細胞中的不同功能的並不是胺基酸序列的微小差異。相反,它們的核苷酸序列--構成其DNA編碼序列的"字母",在兩種形式之間大約有13%的差異,這是它們在生物體的生存和細胞遷移中各自發揮作用的原因。
而在一項新的研究中,研究人員對其原因作出了解釋。β-肌動蛋白mRNA翻譯成蛋白質的速度比γ-肌動蛋白快。這兩種形式都能幫助細胞移動,但β-肌動蛋白更快的速度似乎能使細胞更牢固地附著在基質上,減緩細胞的移動。
賓夕法尼亞大學生物化學教授、該研究的資深作者卡希納說:"在全球哲學層面上,這擴大了我們對遺傳密碼的理解,"該研究發表在《eLife》雜誌上。"我們過去認為,核苷酸的作用是編碼胺基酸,但現在我們看到,實際上,具有相同胺基酸序列的蛋白質具有不同的翻譯率,這使得它們的功能有了不同。"
Kashina用 "沉默的代碼 "一詞來指稱這些核苷酸差異的影響。在早期的工作中,她的團隊表明,在小鼠中,編輯胺基酸序列但保持沉默的核苷酸代碼可以使γ-肌動蛋白在體內表現得像β-肌動蛋白。通常情況下,缺乏β-肌動蛋白的小鼠會在出生前死亡,但研究人員表明,對β-肌動蛋白基因進行基因編輯,使其具有與伽馬-肌動蛋白相同的胺基酸序列,由於核苷酸的不同,小鼠得以存活。
同樣發表在eLife雜誌上的一篇早期論文的發現促使了這項新工作。在早先的研究中,研究人員發現β-肌動蛋白RNA的核糖體密度比γ-肌動蛋白的高得多。核糖體對於從RNA合成蛋白質至關重要,因此科學家們假設,蛋白質翻譯率的這種差異可能是造成γ-肌動蛋白和β-肌動蛋白之間不同功能的原因。
為了測試他們的想法,他們使用細胞系只表達小鼠細胞中的β-和γ-肌動蛋白的編碼部分,以及它們的編輯版本:被編輯為具有與γ-肌動蛋白相同的胺基酸序列的β-肌動蛋白,反之則為γ-肌動蛋白。
當在傷口癒合實驗中進行測試時,研究人員發現,核苷酸序列在決定肌動蛋白促進細胞運動的速度方面至關重要。只表達典型的β-肌動蛋白的細胞以典型的速度遷移,但表達γ-肌動蛋白的細胞的移動速度是其兩倍。含有編輯過的肌動蛋白版本的細胞證明了這種差異是依賴於核苷酸序列的。被編輯成具有伽馬胺基酸序列的β-肌動蛋白像表達伽馬肌動蛋白的細胞一樣移動,而那些具有伽馬肌動蛋白的細胞被編輯成具有β-肌動蛋白的胺基酸序列,以表達β-肌動蛋白的細胞的速度移動。
這些結果令研究人員感到驚訝,因為他們預計β-肌動蛋白mRNA中更高的核糖體密度可以支持更快的翻譯,從而支持更快的移動。而且,事實上,當他們在單分子水平上測量翻譯速度時,他們發現β-肌動蛋白的翻譯速度大約是γ-肌動蛋白的兩倍。
"我們預計更快的翻譯將意味著更快的運動,"Kashina說,"而這不是我們所發現的。我們花了很長時間來解釋原因"。
他們最終發現的是,盡管β-肌動蛋白的亞單位可以比γ-肌動蛋白的亞單位供應得更快,但這種速度對細胞遷移速度是不利的。
"我們發現,你供應得越快,細胞就越能附著在基質上,"Kashina說。"它創造了適當的牽引力,這對正常遷移至關重要。而如果你供應的速度不夠快,細胞就不能正常附著並開始滑動。因此,這解釋了我們看似反直覺的結果。"
Kashina及其同事計劃繼續探究核苷酸序列的作用,包括為什麼進化的力量導致了如此類似形式的肌動蛋白的產生,以及 "沉默的代碼"是否在其他蛋白質中發揮作用。
"我們認為這是一個更大的敘事的一部分,我們相信肌動蛋白是肌動蛋白不是唯一有這種行為的蛋白質。在人類基因組中,有許多蛋白質家族包含由不同基因編碼的高度相似的蛋白質。這種沉默的代碼也可能在這些家族中發揮作用。"
來源:cnBeta
研究稱早餐多攝入蛋白質、晚餐少攝入蛋白質可能是肌肉增長的關鍵
據媒體報導,越來越多的研究表明,保持健康不僅僅是關乎人們攝入的食物類型,還包括一天中某些食物的攝入時間。這個系列的最新研究是來自日本早稻田大學的一項研究,研究人員發現,早上攝入更多的蛋白質,晚上攝入更少的蛋白質可能是肌肉生長和功能的最佳選擇。
如果人們想促進肌肉增長,需要攝入蛋白質。許多人為此轉向蛋白質奶昔和廉價的蛋白質來源,但往往是在一天中的晚些時候食用。新研究表明,最好改變這一習慣,選擇在早餐時攝入大部分蛋白質。
"早餐時攝入蛋白質導致超負荷誘導的肌肉肥大,"新研究報告解釋說,晝夜節律影響了這些積極作用。研究人員表示,在小鼠和人類中都觀察到了這種 「時間營養學」飲食對肌肉功能和生長的改善。
骨骼肌的生長與支鏈胺基酸(BCCA)的消耗有關,而轉基因小鼠被用來確認蛋白質時間和肌肉生長之間的聯系。特別令人感興趣的是,當小鼠的第二餐含有較少的蛋白質數量時,它們仍然體驗到了好處--這與小鼠被餵食的總體較多的蛋白質數量形成對比。
然後研究人員對人類參與者進行了測試,以確定同樣的基於晝夜節律的飲食周期是否會產生類似的影響。這項測試涉及60名65歲及以上的女性。研究人員表示,吃一種主要在早餐而不是晚餐時給予蛋白質的飲食,導致了肌肉功能的改善。
結果表明,人們常見的飲食方式--早餐攝入更多的碳水化合物,晚餐攝入更多的蛋白質--可能需要改變,以獲得最佳的肌肉健康。
來源:cnBeta
生物史最全「證件照」:DeepMind開放35萬種蛋白質結構,超人類知識2倍
今天將成為人類生物學歷史上具有重大意義的一天!智東西7月23日消息,今日,人工智慧研究實驗室DeepMind與歐洲生物信息學研究所EMBL-EBI(European Bioinformatics Institute)合作,推出了AlphaFold蛋白質結構資料庫,該資料庫提供了迄今為止人類蛋白質組最完整、最准確的圖像,是人類積累的高精度人類蛋白質結構知識的兩倍多。 智東西
編譯 | 韋世瑋 徐珊
編輯 | 漠影
除了人類蛋白質組(人類基因組表達的所有蛋白質約2萬種)之外,他們還將提供其他20種具有生物學意義的生物蛋白質組的開放訪問,總計超過35萬種蛋白質結構,包括從果蠅到小鼠等動物,以及從大腸桿菌到酵母等細菌。
發布第一批數據後,DeepMind計劃繼續增加蛋白質庫,幾乎覆蓋所有科學已知的已測序蛋白質,共超過1億種結構,該庫將由EMBL維護。在EMBL總幹事Edith Heard看來:「這些數據集將改變我們對生命運作方式的理解。」
「我認為這是DeepMind整個10年多生命周期的頂峰。」DeepMind聯合創始人兼CEO Demis Hassabis談道,從成立之初,DeepMind就打算將AI方面取得的突破在圍棋、雅達利等遊戲上進行測試,並將其應用於現實世界的問題,以加速科學突破並造福人類。
Demis Hassabis稱,這些數據對科學和商業研究人員來說都將永久免費開放。「任何人都可以將它用於任何事情,他們只需要歸功於參與引用的人。」他說。
▲長期以來,人源中介體復合物(Mediator Complex)一直是結構生物學家最具挑戰性的多蛋白系統之一。(圖源:Nature)
一、AlphaFold預測蛋白質結構,緩解多領域生物研究瓶頸
21世紀是生物的世紀,更是計算機的世紀。
早在去年12月,DeepMind就推出了AlphaFold 2系統,可通過AI軟體對蛋白質結構進行准確預測,該解決方案被認為能解決困擾科學家們50年的蛋白質折疊(protein folding)問題。
直到上周,DeepMind還發表了相關科學論文和原始碼,以解釋如何創建這個高度創新的系統,允許其他人通過AlphaFold來完成相關研究工作。
AlphaFold系統的誕生,證明了AI可以在幾分鍾內准確預測蛋白質的3D結構,精確到原子精度。而AlphaFold蛋白質結構資料庫的開放,也將促進世界各地的科學家們加速對人類蛋白質的研究。
那麼,何為蛋白質折疊問題?
簡單來說,許多生物過程都是圍繞蛋白質來進行的,而蛋白質是由胺基酸序列組成的大型復雜分子,其真正的作用取決於自身獨特的3D結構,也就是蛋白質中胺基酸序列的折疊方式。
了解蛋白質結構能增進人類對生命組成部分的理解,從而推動科學家們在各個領域的研究。
例如,英國朴茨茅斯大學(CEI)正在利用AlphaFold來設計一種新型酶,以快速分解污染嚴重的一次性塑料等廢物;美國科羅拉多大學博爾德分校通過AlphaFold預測,來研究抗生素耐藥性的前景;美國加利福尼亞大學舊金山分校則使用AlphaFold來研究新型冠狀病毒的工作原理……
▲AlphaFold預測的蛋白質結構的兩個例子(藍色)與實驗結果(綠色)的比較(圖源:DeepMind)
這些都是科學家們利用科技帶來的大量生物數據信息,一步步轉換為未來人類的進步。
但科學家們指出,這些信息轉換到現實世界並產生結果的過程,仍需要大量時間。「我認為這不會在一年內改變患者的治療方式,但它肯定會對科學界產生巨大影響。」科羅拉多大學生物化學系教授Marcelo C. Sousa說。
需要注意的是,AlphaFold軟體生成的是蛋白質結構的預測,而不是實驗確定的模型,這意味著在某些情況下,科學家還需要進一步的工作來驗證結構。
DeepMind對此表示,他們花了許多時間在AlphaFold軟體中構建准確度指標,讓它能對每個預測的可信度進行排名。
不過,蛋白質結構的預測仍對科學研究帶來了巨大幫助。以往科學家們確定蛋白質結構的實驗過程既耗時又昂貴,還要依賴大量反復試驗,而蛋白質結構預測即便置信度低,也可以為科學家指明正確的研究方向,為他們節省多年的工作。
英國格拉斯哥大學(University of Glasgow)結構生物學教授Helen Walden認為,DeepMind的數據將「顯著緩解研究瓶頸」,但「進行生物化學和生物學評估的費力、耗費資源的工作」將繼續存在,例如藥物功能研究。
Sousa也提到,他曾在工作中使用過AlphaFold的數據,「科學家們能快速地感受到它帶來的影響。」他說,在他們與DeepMind的合作中,他們有一個包含蛋白質樣本的數據集,但10年來都還沒開發出一個合適的模型,直到DeepMind同意為他們提供一個結構,在15分鍾內就解決了這個問題。
二、蛋白質折疊難題背後,AlphaFold分析速度已提升16倍
AlphaFold只需15分鍾就能解決的問題,為何困擾了這些科學家10年?蛋白質折疊問題究竟難在哪?
如我們前面所說,蛋白質由胺基酸鏈構成,人體中共含有20種不同的胺基酸,任何一個蛋白質都可以由數百個胺基酸組成,且每個胺基酸都有不同的折疊和扭曲結構。
這些都意味著,哪怕是一個常見的蛋白質分子,它的最終結構都有許多種可能構型。一個估計是,典型的蛋白質可以以10^300種方式折疊。不用數了,就是「1」後面跟著300個「0」的可能性。
不過由於蛋白質的樣本太小,科學家們難以用顯微鏡檢查,不得不使用成本昂貴且復雜的方法來間接確定蛋白質結構,比如核磁共振和X射線晶體學(X-ray crystallography)。
但實際上,簡單地通過胺基酸序列來確定蛋白質結構的構想,在理論上一直是難以實現的。因此,分析蛋白質結構也成為了人們攻克生物學領域的一大難關。
直到近年來,人們發現可以利用AI的方法來分析蛋白質結構。藉助這些技術,AI系統可以通過在已知蛋白質結構的數據集上進行訓練,並最終利用這些信息來預測蛋白質結構。
多年來,很多團隊都參與到這項AI研究中,其中DeepMind基於深厚的AI人才庫和大量計算資源基礎,一直走在該領域的前沿。
去年,DeepMind在一項名為CASP的國際蛋白質折疊比賽中脫穎而出,其AlphaFold軟體對蛋白質結構的預測結果非常準確。對此,CASP聯合創始人之一的計算生物學家John Moult說:「在某種意義上,蛋白質折疊的難題已經有了解決方案。」
▲DeepMind的AlphaFold軟體顯著提高了計算蛋白質折疊的准確性(圖源:DeepMind)
自去年CASP競賽以來,AlphaFold系統也實現了升級,現在它分析蛋白質結構的速度已提高了16倍。「我們可以在幾分鍾內折疊一個普通蛋白質,多數情況下只要幾秒鍾。」Hassabis談道。
英國雷丁大學教授Liam McGuffin曾開發出一些蛋白質折疊軟體,他肯定了AlphaFold的技術,但也指出,AlphaFold的成功主要歸功於科學家們數十年的先前研究和公開數據。
「DeepMind擁有大量研究資源來保持資料庫的更新,他們比任何一個學術團體都更有能力做到這一點。」McGuffin認為,盡管科學家們最終也會走到這一步,但速度會更慢,因為他們沒有足夠的資源。
三、持續推進AI發展,年底資料庫結構將增至1.3億個
盡管DeepMind每年都處於大量虧損的狀態,但這次開放蛋白質結構資料庫是免費的。
實際上,DeepMind歸屬於Google母公司Alphabet,該公司一直在商業醫療保健領域投入大量資源。還有許多報導稱,DeepMind與Alphabet在研究自主性和商業可行性等問題上存在分歧。
不過Hassabis談道,公司一直在計劃免費提供這些信息,這樣做是對DeepMind創始精神的體現。「我們在被收購時與Alphabet達成的協議是,DeepMind主要的研究目的是推進AGI(通用人工智慧)和AI技術的發展,然後利用它們來攻克科學領域的難題。」他說。
他認為,Alphabet有許多部門都專注於盈利,但DeepMind對研究的關注能夠「為科學界帶來各種各樣的好處,包括聲望和信譽,從而通過多種方法實現價值。」
Hassabis還強調,雖然DeepMind的主要研究目標是一些基礎領域,但其技術已廣泛應用於Google的其他業務中。「幾乎你使用的任何Google產品,其中一部分技術都有我們的參與。」他透露。
與此同時,Hassabis預測AlphaFold將成為未來的標志,因為它展示了AI在處理人類生物學等復雜問題上的巨大潛力。
「我認為我們正處於一個非常激動人心的時刻。」Hassabis提到:「在接下來的十年中,我們和AI領域的其他人都希望能取得突破性進展,真正加速解決我們在地球上面臨的真正重大問題。」
對於接下來的計劃,EMBL-EBI的結構生物信息學Sameer...
研究:在早餐時攝入更多蛋白質可促進骨骼肌的健康和生長
據媒體New Atlas報導,日本研究人員的一項新研究表明,一個人對膳食蛋白質的代謝受到他們進食時間的影響。該研究發現,在早餐時攝入蛋白質可促進骨骼肌的健康和生長。
時間營養學(Chrono-nutrition )是營養科學的一個相對較新的領域,探索晝夜節律影響我們的代謝功能的方式。簡單地說,有越來越多的證據表明,我們何時進食與我們吃什麼一樣重要。
幾十年來,人們一直在質疑在晚上吃一天中最豐富的一餐是否是最佳狀態。雖然一些研究將肥胖與在晚餐時攝入大部分的熱量負荷聯系起來,但顯然每個人的生物鍾都可能不同。因此,任何通用的一刀切的飲食規則可能是徒勞的。
這項新研究旨在具體研究一天中的時間如何影響蛋白質的代謝,特別是在骨骼肌生長方面。第一步的研究重點是每天被餵食兩頓不同蛋白質含量的飲食的小鼠。研究人員發現,早上攝入的蛋白質比晚上攝入的蛋白質更容易誘發骨骼肌的生長。更有趣的是,早餐攝入8.5%蛋白質的小鼠與晚餐攝入11.5%蛋白質的小鼠相比,其肌肉生長速度高出17%。
用缺乏調節晝夜節律的基因的小鼠進行的進一步實驗發現,早餐和晚餐之間的骨骼肌肉生長沒有差異。這肯定了生物體的生物鍾似乎對蛋白質代謝的影響。研究的最後部分招募了60名從飲食調查中選出的受試者。半數受試者習慣性地在晚餐時攝入大部分的日常蛋白質,而另一半人則在早餐時攝入更多的蛋白質。
那些早餐攝入大量蛋白質的受試者顯示出更高的骨骼肌質量,並在握力測試中表現更好。研究人員謹慎地指出,人類的這部分研究並不是蛋白質攝入時間和骨骼肌肉質量之間因果關系的明確證據。相反,它只是表明一種可能與動物研究結果有關的相關性。
來自早稻田大學的研究負責人Shigenobu Shibata說,西方和亞洲的飲食往往在早餐中的蛋白質含量較低。他表示,雖然肯定需要更多的研究來更好地了解晝夜節律是如何影響蛋白質代謝和肌肉體積的,但迄今為止的證據表明,在晚餐中應攝入較少的蛋白質,而在早餐中應攝入更多的蛋白質。
Shigenobu Shibata說:「對人類來說,一般來說,早餐的蛋白質攝入量平均約為15克,這比我們在晚餐時的攝入量少,後者大約為28克。我們的研究結果強烈支持改變這種常態,在早餐或早晨吃零食的時間攝入更多的蛋白質。」
這項新研究發表在《細胞報告》雜誌上。
來源:cnBeta
AlphaFold2成功以前所未有的准確度預測典型蛋白質的結構
英國《自然》雜誌16日發表的一項結構生物學最新研究,世界著名人工智慧團隊深度思維(DeepMind)描述了神經網絡「阿爾法折疊2」(AlphaFold2),就計算機方法而言,「阿爾法折疊2」能以前所未有的准確度根據蛋白質的胺基酸序列預測其三維結構。
蛋白質折疊問題被認為是人類在21世紀需要解決的重要科學前沿問題之一。理解蛋白質的結構有助於確定蛋白質的功能,了解各種突變的作用。
截至目前,約有10萬個蛋白質的結構已經用實驗方法得到了解析,但這在已經測序的數10億計蛋白質中只占了很小一部分。在過去50多年的時間里,研究人員一直嘗試根據蛋白質的胺基酸序列預測其折疊而成的三維結構。然而,當前使用的計算方法准確度有限,實驗方法對人力和時間的要求也非常高。
此次,深度思維首席科學家約翰·詹普爾、創始人兼執行長戴米斯·哈薩比斯及其團隊描述了「阿爾法折疊2」——一個基於神經網絡的新模型,其預測的蛋白質結構能達到原子水平的准確度。研究團隊在2020年5月至7月舉辦的第14屆「蛋白質結構預測關鍵評估」(CASP14)大賽中驗證了這種方法。
CASP14比賽要求參賽團隊根據蛋白質的胺基酸序列解析它們的結構。比賽用的蛋白質會先用實驗方法解析出來,但具體結果不會公開。比賽中,「阿爾法折疊2」預測的大部分結構達到了空前的准確度,不僅與實驗方法不相上下,還遠超解析新蛋白質結構的其他方法。將實驗方法得到的蛋白質結構疊加在「阿爾法折疊2」的結構上,組成蛋白質主鏈骨架的疊加原子之間的距離中位數(95%的覆蓋率)為0.96埃(0.096納米)。成績排第二的方法只能達到2.8埃的准確度。
「阿爾法折疊2」的神經網絡能在幾分鍾內預測出一個典型蛋白質的結構,還能預測較大蛋白質(比如一個含有2180個胺基酸、無同源結構的蛋白質)的結構。該模型能根據每個胺基酸對其預測可靠性進行精確預估,方便研究人員使用其預測結果。
研究團隊認為,這一精準的預測算法可以讓蛋白質結構解析技術跟上基因組革命的發展步伐。
戴米斯·哈薩比斯則在一份聲明中表示:在CASP14大會上,他們揭曉了一個可以將蛋白質3D結構預測精確到原子水平的全新「阿爾法折疊」系統,他們承諾會分享該方法,並為科學共同體提供廣泛、免費的獲取途徑。而今他們邁出了承諾的第一步——在《自然》期刊上分享「阿爾法折疊」的開原始碼,並發表了系統的完整方法論,以期待看到該方法為科學界啟發出其他新的研究方法。
「阿爾法折疊」第一代的問世,被認為改變了結構生物學和蛋白質研究的未來:實驗學家將能使用精確結構預測來理解不透明的低溫電磁數據;藥物設計者也可藉此迅速釐清新冠病毒等危險病原體中每種蛋白質的結構,從而更快研發出相關藥物。
來源:cnBeta
科學家在致命蜘蛛毒液中發現可以阻斷心臟病「死亡信號」的蛋白質
據媒體報導,雖然看起來不太可能,但這種致命漏鬥網蜘蛛的毒液可能被證明是一些救命藥物的寶貴來源,其中包括殺死皮膚癌和減少中風患者腦損傷的藥物。新的研究表明,基於這種蜘蛛毒液中的分子構建的候選藥物可以阻止心臟病發作的「死亡信號」,這可能為急救人員提供了一種強有力的新干預方式。
這項工作是由澳大利亞昆士蘭大學的科學家們進行的,實際上是建立在之前的一項研究的基礎上,他們在漏鬥網蜘蛛的毒液中發現了一種具有相當有潛力的小蛋白質。通過對老鼠的實驗,研究小組發現,在誘發中風後使用這種特殊的蛋白質能夠顯著降低腦損傷的可能性,甚至是在中風發生數小時後就能實現。
Glenn King教授說道:「我們發現這種名為Hi1a的小蛋白質即使在中風發作八小時後服用也能驚人地減少對大腦的損傷。同時,在心臟細胞上測試Hi1a也很有意義,因為跟大腦一樣,心臟是身體中對血液流失和缺氧最敏感的器官之一。」
為了探索這些可能性,科學家們在人類心臟細胞上測試了這種藥物,他們在細胞上模擬心臟病發作時的壓力。最終該藥物被發現可以阻斷所謂的「死亡信號」,而這種信號通常會在心臟病發作時擴散至所有的心臟細胞。
該研究的論文作者Nathan Palpant指出:「心臟病發作後,流向心臟的血液減少進而導致心肌缺氧。缺氧會導致細胞環境變酸,這兩種因素結合在一起會給心臟細胞發出死亡的信號。」
研究小組發現,Hi1a通過阻斷心臟中的酸感應離子通道來達到這種效果,而酸感應離子通道反過來又阻斷了死亡信號的傳遞從而允許更多的心臟細胞存活。目前還沒有藥物可以阻斷這種死亡信號,臨床也沒有藥物可以挽救心臟病發作後的器官免受這種損害。
「對於心臟病患者,我們對未來的願景是Hi1a可以由救護車上的急救人員管理,這將真正改變心臟病的健康結果,」King說道,「這在澳大利亞的農村和偏遠地區尤為重要,因為那里的病人和治療醫院相距很遠,而此時每一秒都非常重要。」
除了可能挽救心臟病患者的生命外,該藥物還可以通過增加心臟細胞的存活率為器官移植爭取時間。這可以在心臟停止跳動後為移植心臟提供關鍵的額外時間並提高移植成功的幾率。
科學家們希望在這些有希望的早期結果的基礎上在未來兩到三年內通過人類臨床試驗來研究Hi1a作為中風和心臟病的治療方法。
Peter Macdonald表示:「這不僅可以幫助全世界每年成千上萬的心臟病患者,還可以增加捐贈心臟的數量和質量,這將給那些等待移植名單的人帶來希望。」
來源:cnBeta
新研究揭示抑鬱症、PTSD等壓力相關疾病背後蛋白質的相互作用
據媒體報導,壓力相關的精神疾病--包括重度抑鬱症和創傷後應激障礙(PTSD)的生物學機制目前尚不清楚。現在,一項新研究詳細闡述了參與控制身體應激反應的蛋白質之間的相互作用,另外它還指出了這種反應出錯時的潛在治療靶點。 這項研究是由麥克萊恩醫院的研究人員領導的國際團隊展開,相關研究已發表在《Cell Reports》上。
研究強調:
新研究揭示了關鍵蛋白質如何相互作用來調節身體對壓力的反應;
針對這些蛋白質可能有助於治療或預防與壓力相關的精神疾病。
這項研究的首席作者Jakob Hartmann博士指出:「身體的應激反應失調會損害大腦並促進情緒和焦慮症的易感性。」據悉 ,Hartmann是麥克萊恩恐懼實驗室神經生物學的助理神經科學家,另外還是哈佛醫學院精神病學講師。
Hartmann稱:「海馬體是調節壓力反應的關鍵大腦區域。當我們注意到三種重要的應激調節蛋白在海馬體定位上的有趣差異時我們產生了進行這項研究的想法。」
研究人員在非人體組織和死後腦組織中進行的實驗揭示了這些蛋白質--糖皮質激素受體(GR)、礦物皮質激素受體(MR)和FK506結合蛋白51(fkbp5)--是如何相互作用的。
具體來說,在正常條件下,是MR而非GR控制FKBP5的產生。在壓力情況下,FKBP5會降低GR對結合應激激素的敏感性。FKBP5似乎可以通過調節海馬體中MR:GR平衡來微調應激反應。
這項研究的高級作者Kerry J. Ressler醫學博士會出:「我們的研究結果表明,GR、MR和FKBP5的治療靶向可能在控制中樞和外周應激調節方面是互補的。」Ressler是麥克萊恩醫院的首席科學官、麥克萊恩抑鬱症和焦慮症部門的主任、哈佛醫學院的精神病學教授。
「此外,我們的數據進一步強調了磁共振信號在跟壓力相關的精神疾病中的重要作用,但很大程度上還未被重視。這項研究的發現將為未來的研究開辟新的方向,」Ressler補充道。
來源:cnBeta
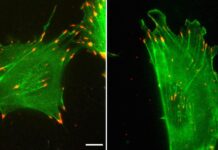
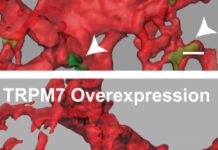
研究:保護性蛋白質TRPM7可防止癌細胞擴散到血液中
據媒體報導,當癌症擴散到全身時它會變得更加危險。現在,來自約翰霍普金斯大學的研究人員已經發現了一種阻止細胞進入血液的蛋白質,另外他們還發現轉移的癌細胞忽略了它。這些可能為癌症治療揭示一個新的藥物靶點。 癌症的主動性無疑是令人沮喪的。當它在身體的某個部位站穩之後,它往往會開始脫落一些流氓細胞,這些細胞冒險則會進入血液然後轉移到其他器官進而建立一個新的「殖民地」。這種轉移過程使得癌症更難追蹤和清除,也因此更加致命。
於是,尋找預防轉移的方法成為了癌症研究的一個主要部分。近年來,科學家們發現了有助於腫瘤擴散的分子、蛋白質和蛋白質信號通路,這為開發針對這些分子的藥物提供了良好的起點。現有的一種藥物已經被發現可以修補癌細胞更容易穿透的滲漏血管。使用納米顆粒包裹免疫細胞可以幫助它們追蹤血液中的流氓癌細胞,或改變飲食可以幫助減少轉移的機會。
在這項新研究中,研究人員發現了一種蛋白質,它可能能成為預防轉移的新的潛在藥物靶點。研究人員早就知道它可以調節細胞中的鈣水平,但他們現在發現,這種蛋白質還有另一種功能,即可能在轉移中發揮作用。
該研究的首席作者Kaustav Bera表示:「我們發現,這種名為TRPM7的蛋白質能夠感知循環系統中液體流動的壓力並阻止細胞在血管系統中擴散。我們發現轉移性腫瘤細胞顯著降低了這種傳感器蛋白的水平,這就是它們能有效地進入循環而不是離開液體流動的原因。」
有趣的是,健康細胞的TRPM7含量比腫瘤細胞高得多,這就很好地解釋了為什麼癌症更容易擴散。
研究小組還發現,細胞在一種類似階梯的微通道血流模型中移動,另外血流被精心控制。他們發現,健康的成纖維細胞會因液體流動而改變方向,但會進入液體靜止的通道。
接下來,研究人員阻止了細胞表達TRPM7蛋白--果然,這次它們忽略了液體的流動、直接進入了那些快速流動的通道。相反,當它們編輯腫瘤細胞以表達更多的蛋白質時又對液體流動變得敏感了。
雖然目前這一研究還處於早期階段,但最新的發現可能為一種通過靶向TRPM7蛋白來預防癌症轉移的新療法鋪平了道路。
該研究的資深作者Konstantinos Konstantopoulos指出:「在將其應用於臨床之前,我們還需要進一步的研究進展,但我們相信,我們首次提供了TRPM7在腫瘤轉移的關鍵步驟中所起作用的明確圖像。」
來源:cnBeta
研究:蛋白質「大爆炸」揭示了醫學和生物工程應用的分子構成
據媒體報導,伊利諾伊大學的 Gustavo Caetano-Anollés 和 Fayez Aziz 的研究揭示了稱為結構域(domain)的蛋白質亞基進化過程中的「大爆炸」。研究人員在《科學報告》上發表的一項新研究,描繪了38億年來蛋白質結構域(蛋白質分子的子單元)的進化歷史和相互關系。他們的結果可能對疫苗開發和疾病管理產生影響。
自從COVID-19大流行開始以來,蛋白質已經悄悄地「接管」了人們的生活。人們一直生活在該病毒所謂的「刺突糖蛋白」的支配下,它已經變異了幾十次,產生了越來越致命的變種。但事實是,我們一直都被蛋白質所「統治」。在細胞層面,它們負責幾乎所有的事情。
蛋白質是如此基本,以至於DNA--使我們每個人都獨一無二的遺傳物質--本質上只是一長串的蛋白質藍圖。這對動物、植物、真菌、細菌、古細菌,甚至病毒都是如此。正如這些生物群體隨著時間的推移而進化和變化一樣,蛋白質及其組成部分也是如此。
「了解結構域在進化過程中如何以及為何在蛋白質中結合,可以幫助科學家了解和設計蛋白質的活性,用於醫學和生物工程的應用。例如,這些見解可以指導疾病管理,例如用COVID-19病毒的刺突糖蛋白製作更好的疫苗,」伊利諾伊大學卡爾-R-沃斯基因組生物學研究所作物科學系教授、該論文的資深作者Gustavo Caetano-Anollés說。
Caetano-Anollés研究了自大流行病早期階段以來COVID突變的演變,但這一時間線只代表了他和博士生Fayez Aziz在當前研究中所承擔的一小部分。
研究人員彙編了所有分類組(包括高等生物和微生物)數百個基因組中編碼的數百萬條蛋白質序列的序列和結構。他們關注的不是整個蛋白質,而是結構域。「大多數蛋白質是由一個以上的結構域組成的。這些是緊湊的結構單元,或模塊,承載著專門的功能,」Caetano-Anollés說。「更重要的是,它們是進化的單位。」
在將蛋白質分類為結構域以建立進化樹之後,他們著手建立一個網絡,以了解結構域如何在數十億年的進化過程中發展並在蛋白質中共享。
「我們建立了一個時間序列的網絡,描述了結構域是如何積累的,以及蛋白質是如何通過進化重新排列其結構域的。」Fayez Aziz說:「這是第一次將這樣的'結構域'網絡作為進化年表來研究。我們的調查顯示,有一個龐大的演化網絡,描述了蛋白質中的結構域如何相互結合。」
該網絡的每一個連結都代表了一個特定的結構域被招募到一個蛋白質中的時刻,通常是為了執行一個新的功能。
Fayez Aziz說:「僅這一事實就強烈地表明結構域的招募是自然界的一種強大力量。年表還揭示了哪些結構域貢獻了重要的蛋白質功能。例如,研究人員能夠追蹤負責環境感知以及次級代謝物或用於細菌和植物防禦的毒素的結構域的起源。」
分析顯示,在蛋白質進化的早期,結構域開始結合,但也有網絡爆炸性增長的時期。例如,研究人員描述了15億年前領域組合的 "大爆炸",與多細胞生物和真核生物(包括人類在內的具有膜結合核的生物)的崛起相吻合。
Caetano-Anollés團隊之前報導了新陳代謝的大規模和早期起源,他們最近在追蹤新陳代謝網絡的歷史時再次發現了這一點。描述蛋白質進化拼湊的「大爆炸」的歷史記錄為理解蛋白質構成提供了新的工具。
「這可能有助於確定,例如,為什麼結構變異和基因組重組在SARS-CoV-2中經常發生,」Caetano-Anollés說。
他補充說,這種理解蛋白質的新方法可以通過剖析病毒疾病的起源來幫助預防大流行病。它還可以在疾病爆發時通過改進疫苗設計來幫助緩解疾病。
來源:cnBeta
「化學開關」觸發了涉及阿爾茨海默病的蛋白質的毒性
來自東京都立大學的研究人員發現,一種被稱為tau的關鍵蛋白質的特定化學特徵可能導致它在大腦中積累,並引發像阿爾茨海默氏症這樣的疾病。他們發現,某些胺基酸上的二硫鍵起到了穩定tau的作用,並導致其積累,這種影響隨著氧化壓力的增加而變得更加嚴重,識別觸發tau積聚的化學目標可能帶來突破性的治療方法。
tau蛋白是生物細胞健康功能的關鍵。它有助於形成和穩定微管,微管是縱橫交錯的細胞內部的細絲,有助於保持細胞結構的剛性,並為細胞器之間的分子穿梭提供 "高速公路"。然而,當它們不能正確形成時,它們會累積並形成粘性團塊。在大腦中,這些聚集物阻礙了神經元的發射,並導致了廣泛的神經退行性疾病,即所謂的tauopathies,其中之一就是著名的阿爾茨海默病。因此,科學家們找到將tau從細胞功能的一個不可或缺的部分轉變為致命病理的 "開關"是非常重要的。
由東京都立大學的Kanae Ando副教授領導的一個團隊使用像果蠅這樣的模式生物來揭示tau蛋白的特定特徵如何導致其停止正常工作。蒼蠅可以通過基因改變來表達與人類相同的tau蛋白。通過系統地修改編碼tau的部分基因,他們試圖確定突變的tau蛋白的某些特徵如何影響其行為。
帶有半胱氨酸基團的Tau蛋白在氧化壓力下發生化學變化,形成二硫鍵,使tau蛋白的毒性突變體能夠聚集。這些會繼續導致神經退化。抗氧化劑可以幫助將這些物質還原成硫醇;然後這些正常的tau蛋白可以被細胞自然清除。資料來源:東京都立大學
在他們最近的工作中,他們發現蛋白質中被稱為半胱氨酸的胺基酸殘基在兩個不同的位置(C291和C322)的改變對tau的數量和毒性有很大的影響。在進一步的突破中,研究小組確定了負責使其對正常細胞功能產生毒性的具體化學特徵,即這些半胱氨酸基團形成的二硫鍵。當細胞被置於活性氧水平升高的環境中時,tau的毒性積累變得更加嚴重,因為半胱氨酸上的硫醇基團被氧化,形成二硫鍵。氧化應激升高的生化環境與在tauopathies患者身上看到的相似。共同表達抗氧化劑來對抗這種影響有助於自然過程清除tau蛋白,從而使tau水平大幅降低。
研究小組希望了解究竟哪些化學基團負責tau的毒性可能會導致減少或防止tau積累的新療法,以幫助世界各地的tauopathies患者。
來源:cnBeta
從源頭上解決食物過敏問題 研究人員開發沒有過敏性蛋白質的非轉基因大豆
食物過敏是一個大問題。在美國,大約7%的兒童和2%的成年人患有某種食物過敏。這些過敏症每年花費高達250億美元的醫療費用,然後是需要大量損失在學校或工作中的時間,還有嚴重並發症的風險,甚至死亡。
找到減少食物過敏造成的痛苦的方法是至關重要的。食品加工公司已經花了很多精力為產品貼上標簽,以便人們能夠避免對其過敏的物品。但如果我們能做得更好呢?如果我們能夠享受我們喜歡的食物而不擔心它們會引發健康危機呢?
這就是艾略特·赫爾曼的工作重點。赫曼在他的職業生涯中一直在研究為什麼植物會引發過敏反應,以及如何減少它們被引發的機會。赫曼是美國作物科學學會的成員,並在虛擬的2020年ASA-CSSA-SSSA年會上介紹了他的工作。
"食物過敏是一個重要的社會問題。通過改變食物和治療敏感個體,可以減輕這種情況,改善他們的生活,影響美國的醫療總支出,"赫爾曼說。他特別關注大豆。大豆過敏尤其影響兒童和嬰兒。而且由於大豆產品如油和蛋白質被用於無數的食品中,所以很難避免。在其職業生涯的早期,赫爾曼發現了由大豆製成的蛋白質,它是大多數大豆過敏的原因。現在,他致力於了解為什麼這種蛋白質會如此惡化,以及我們如何能夠減少作物中的蛋白質。
為了做到這一點,他轉向了動物模型。豬有時會出現與人類非常相似的大豆過敏現象。赫爾曼與一個研究小組合作,培育出對大豆特別敏感的豬。在過敏性兒童身上測試新作物是不可能的。但是這些豬可以用來觀察植物育種者在去除大豆種子中的過敏性蛋白質方面做得如何。
一頭對大豆高度過敏的豬對注射過敏性蛋白表現出強烈的反應(左,右下),而一頭過敏性較低的豬只在注射部位有反應(右上)。豬可以作為人的大豆過敏的有用模型,幫助測試低過敏性的大豆。資料來源:Allan Schinckel
此前,赫爾曼與杜邦公司合作,生產了一個不能製造最易過敏的蛋白質的大豆系列。他們利用基因工程製造了這個大豆系列。這種新的大豆是一種轉基因生物(GMO)。但人們希望獲得一種沒有過敏性蛋白質的非轉基因大豆。因此,赫爾曼又回到了研究室,他和他的同事們一起從美國農業部(USDA)的國家大豆系列中找到了一個自然不產生過敏性蛋白質的品種。這意味著沒有必要進行基因工程。然後他們將這一品系的大豆與一種更普遍種植的大豆進行雜交,創造出一種新的、高產的大豆,降低了過敏性敏感性。這種新大豆旨在成為低過敏原的原型,作為常規的非轉基因品系進行測試,以減輕消費者的過敏反應。
現在可以用高敏豬來測試這些低過敏原大豆對過敏體質的人是否足夠安全。這不僅對那些想安全地從雜貨店吃更多東西的過敏者有好處。這對動物來說也是一個好消息。
因為豬經常被餵食大豆,低過敏原的大豆可以減少它們自己的過敏反應。狗對大豆的過敏反應的發生率也很高,一些狗糧中就使用大豆。因此,減少作物的過敏性對人類最好的朋友也有好處。
"自古以來,食物就被認為是藥物。通過減少大豆的過敏原,我們希望對人類和動物產生積極的醫療效果,"赫爾曼說。
來源:cnBeta
研究發現蛋白質PLIN5可以促進脂肪燃燒並降低患糖尿病的風險
據媒體報導,通過更好地理解體內不同類型脂肪的生物學基礎,科學家們希望能找到解決肥胖及其相關問題的新方法。研究人員現在發現,增加棕色脂肪中某種蛋白質的水平可以通過改變白色脂肪細胞的行為為有糖尿病風險的人提供保護。 白色脂肪是形成腰間贅肉和啤酒肚的脂肪類型,其將身體大部分多餘的能量儲存在鬆弛的組織中。另一方面,褐色脂肪負責燃燒卡路里以在寒冷中保持身體溫暖。人們對促進棕色脂肪的形成而非白色脂肪作為一種幫助人們減肥的方式有著相當大的興趣,但這項新研究的作者們關注的是它如何可能還有預防2型糖尿病發展的作用。
對此,德克薩斯大學西南醫學中心進行的這項研究集中在一種名為PLIN5的蛋白質上,它覆蓋在細胞內的脂滴上--特別是那些棕色脂肪。科學家們通過對經過基因工程改造的棕色脂肪組織中含有高水平PLIN5的老鼠進行實驗並觀察其影響從而探索其作用。
很大比例的2型糖尿病是由肥胖引起的,這種疾病的特徵包括高血糖水平、對幫助身體處理葡萄糖的胰島素的抵抗及脂肪肝。跟PLIN5水平正常的對照組相比,基因工程小鼠在所有這些方面都表現良好、血糖顯著降低、胰島素敏感性更高、脂肪肝更少。
通過進一步的調查,研究小組集中研究了這些影響背後的原因。這部分跟棕色脂肪組織線粒體的變化有關,他們發現,這種組織適應了在室溫下燃燒更多的脂肪,就像動物被放置在寒冷的環境中一樣。但科學家們還發現,經過基因改造的老鼠體內的白色脂肪細胞縮小了、炎症也減少了,這兩項都是胰島素敏感性和糖處理能力提高的標志。
研究負責人Perry E. Bickel指出:「通過利用這個自然系統,我們可能能夠幫助脂肪庫在新陳代謝方面變得更加健康,並有可能預防或治療跟肥胖相關的糖尿病。」
這些發現有望更好地理解肥胖是如何導致2型糖尿病和類似疾病的並為治療提供了一個新的潛在目標。然而很顯然,研究人員仍有大量的工作要做--不僅要嘗試將小鼠的結果轉化到人類身上還要理解棕色脂肪是如何使白色脂肪產生下游變化的。科學家們表示,一種可能是它將某種分子因子傳送到血液中。
「我們想要解決的下一個問題是,」Bickel說道,「是什麼因素以及我們是否可以利用它來治療。」
來源:cnBeta
研究表明依賴睡眠的大腦活動可清除有毒蛋白質並預防阿爾茨海默病的發生
據媒體報導,賓夕法尼亞州立大學的劉曉及其同事6月1日在期刊《PLOS生物學》上發表的研究中,提出了在清除阿爾茨海默病相關毒素堆積的過程中依賴睡眠的低頻(<0.1 Hz)全腦活動的證據。在健康對照組中,這種神經元活動與腦脊液流動的聯系比高風險組和患者更緊密,這些發現可以作為臨床醫生評估患者的潛在成像標記。
阿爾茨海默病的發展被認為是由有毒蛋白質β-澱粉樣蛋白和tau在大腦中的堆積所驅動。大腦的類淋巴系統在清除這些毒素方面發揮著至關重要的作用。以前的工作表明,睡眠依賴性的全球大腦活動和飲水系統之間可能存在關系,顯示這種活動與飲水系統所必需的腦脊液流動相耦合。
研究人員利用阿爾茨海默病神經影像倡議項目中的118名受試者,測量了這種全腦活動和腦脊液流動,同時也觀察了行為數據。研究小組將他們的研究結果與阿爾茨海默病相關的神經生物學和神經心理學標志物(如毒性β-澱粉樣蛋白的水平)進行了比較,每個人都接受了間隔兩年的靜止狀態fMRI檢查。
在風險較高或已經患上阿爾茨海默病的人中,大腦活動和腦脊液流動之間的聯系強度較弱。此外,這種較弱的聯系與兩年後較高的β-澱粉樣蛋白水平和與疾病有關的行為措施有關。這表明依賴睡眠的全球大腦活動在清除大腦廢物方面發揮著重要作用,它與腦脊液流動的聯系可能有助於作為未來臨床評估的標志。
劉曉博士補充說:「該研究將靜止狀態下的全腦活動和腦脊液流動與阿爾茨海默病的病理學聯系起來。這一發現強調了低頻(<0.1 Hz)靜息態神經和生理動態在神經退行性疾病中的潛在作用,可能是由於其睡眠依賴性驅動腦脊液流動以沖走大腦毒素。未來的研究需要充分了解全球大腦活動和相關的生理調節及其在腦脊液清除和神經退行性疾病中的作用。」
來源:cnBeta
對蚊蟲體內蛋白質的研究可能帶來對抗病毒的全新模式
據美國國立衛生研究院(NIH)的科學家及其合作者稱,蚊子蛋白AEG12能強烈抑制引起黃熱病、登革熱、西尼羅河和寨卡的病毒家族,但對冠狀病毒的抑製作用較弱。研究人員發現,AEG12通過破壞病毒包膜的穩定性來發揮作用,打破其保護層。
盡管這種蛋白質並不影響那些沒有包膜的病毒,例如那些導致紅眼病和膀胱感染的病毒,但這些發現可能會導致針對影響全世界數百萬人的病毒的治療方法。該研究報告在線發表於《美國科學院院刊》。
美國國立衛生研究院(NIH)下屬的國家環境健康科學研究所(NIEHS)的科學家們使用X射線晶體學分析出AEG12的結構。高級作者、NIEHS核磁共振組組長Geoffrey Mueller博士說,在分子水平上,AEG12撕開了脂質,或將病毒固定在一起的膜的脂肪狀部分。
Mueller說:"AEG12看上去對病毒膜中的脂質很飢渴,所以它擺脫了它所擁有的一些脂質,並將它們換成它真正喜歡的脂質。該蛋白對病毒脂質有很高的親和力,並從病毒中竊取它們。"因此,AEG12蛋白對一些病毒有很大的殺傷力。
雖然研究人員證明AEG12對黃病毒(寨卡、西尼羅河和其他病毒所屬的家族)最有效,但AEG12也有可能對SARS-CoV-2(引起COVID-19的冠狀病毒)有效,但明顯較弱,要使AEG12成為COVID-19的可行療法,還需要多年的生物工程。部分原因是AEG12也會破壞紅血球,因此研究人員將不得不需要先確定能使該蛋白只針對病毒的化合物。
NIEHS訪問學者、該論文的主要作者Alexander Foo博士解釋說,蚊子在吸血或感染了黃病毒後都會產生AEG12。像人類一樣,蚊子對這些病毒產生了強烈的免疫反應,AEG12使它們的病毒覆蓋面破裂。
Foo表示:"研究一種新的蛋白質的前景是令人興奮的,但也是令人生畏的,值得慶幸的是,我們有足夠的線索,並能在NIEHS獲得廣泛的專業知識來拼湊它。"
合著者和晶體學專家Lars Pedersen博士是NIEHS結構功能組的負責人。他在工作中經常使用關於分子的物理構成的信息,並鼓勵更多的科學家考慮在他們的研究中使用這些數據。他說:"我們的研究表明,了解一個蛋白質的結構對於弄清它的作用和如何幫助治療疾病是非常重要的。"
來源:cnBeta
生物學家「穿越時空」超30億年 破解細胞蛋白質合成機制的重要部分
烏普薩拉大學的一個研究小組成功地研究了 "翻譯因子"--細胞蛋白質合成機制的重要組成部分,這種機制已持續了幾十億年。通過研究這些古老的 "復活"因子,研究人員能夠確定它們比現在的、更專業的對應物具有更廣泛的特性。
為了生存和生長,所有細胞都包含一個內部的蛋白質合成工廠。這由核糖體和相關的翻譯因子組成,它們一起工作以確保復雜的蛋白質生產過程順利進行,但直到現在科學家們還不知道這個過程是如何演變的。
發表在《分子生物學與進化》雜誌上的這項新研究,將細胞和分子生物學系的Suparna Sanyal教授領導的研究小組帶入了一個回到過去的史詩般的旅程。之前發表的一項研究使用了一種特殊的算法來預測一種重要的翻譯因子的祖先的DNA序列,這種翻譯因子被稱為熱不穩定延長因子,或EF-Tu,可以追溯到數十億年前。烏普薩拉研究小組利用這些DNA序列復活了古老的細菌EF-Tu蛋白,然後研究其特性。
研究人員查看了EF-Tu進化史上的幾個節點。他們創造的最古老的蛋白質大約有33億年歷史。
Suparna Sanyal是烏普薩拉大學細胞和分子生物學系的教授
"看到祖先的EF-Tu蛋白與地球上相應時間段的地質溫度相匹配,這很令人驚訝。"Suparna Sanyal說:"30億年前的天氣要暖和得多,這些蛋白質在70°C時甚至功能都保持良好,而3億年前的蛋白質只能承受50°C。"
研究人員能夠證明古代的延伸因子與各種類型的核糖體兼容,因此可以被歸類為"萬能鑰匙",而它們的現代後代則已經進化為履行更專一的任務。雖然這使它們更有效率,但它們需要特定的核糖體才能正常運作。研究結果還表明,核糖體可能是在其他相關翻譯因子之前進化出了它們的RNA核心。
"我們現在知道蛋白質合成是如何進化到這一點的,這使得我們有可能對未來進行建模。如果翻譯因子已經進化到了這樣的專業化水平,那麼將來會發生什麼,例如在新的突變情況下?"Suparna Sanyal提出了這樣的問題。
研究人員已經證明有可能重新創造這種古老的蛋白質,而且極其古老的翻譯因子與許多不同類型的核糖體配合得很好,這一事實表明,這一過程對蛋白質制藥研究具有潛在的興趣。如果事實證明,蛋白質合成的其他古老成分也是通用的,那麼將來就有可能利用這些古老的變種,用非天然或合成成分來生產治療性的蛋白質。
來源:cnBeta
研究:當關鍵蛋白質被剝奪時,「成癮」的胰腺癌細胞將能被殺死
據媒體報導,通過更好地了解癌細胞在人體中生長的方式,科學家們得以繼續了解它們的弱點在哪里並由此找出潛在的新治療形式。採用這種方法的加拿大研究人員近日在胰腺癌領域有了重大發現,他們在實驗室中找到了細胞賴以生長的一種蛋白質並將其作為抑制腫瘤生長的靶點。
該研究由瑪格麗特公主癌症中心的科學家們領導,其重點是研究胰腺癌細胞的獨特生物學特性。據悉,這種細胞導致了一種特別致命的疾病,其五年存活率只有8%。科學家們知道,這些癌細胞會增加一種名為NADPH的關鍵代謝物的水平,這種代謝物有助於促進癌細胞的生長,因此他們進行了基因組分析以進一步闡明這一過程。
研究顯示,擁有NADPH水平高且生長不受控制的細胞雖然是遭受氧化應激後的結果,但一種名為PRDX4的抗氧化蛋白能對抗這些影響且讓細胞得以存活。從這個意義上來說,癌細胞高度依賴或「沉迷於」這種蛋白質,科學家們希望利用這種蛋白質來達到他們的目的。
接下來,科學家們證明,通過靶向患者來源的胰腺癌細胞中的PRDX4蛋白,它們可能會導致氧化應激的毒性積累從而引發DNA損傷和細胞死亡。最終,這項技術能損害臨床前模型中的腫瘤生長,更重要的是,使正常的健康細胞不會受到傷害。
「殺死癌細胞並不難,」領導這項研究的Marianne Koritzinsky博士說道,「很難在不傷害癌症患者的情況下殺死癌細胞。」
通過這種方式,專門針對PRDX4蛋白開發的藥物可能能極大地促進胰腺癌的治療。這些雖然需要首先在實驗室接受測試然後再進行臨床試驗,但Koritzinsky現在正在探索這些可能性。
來源:cnBeta
珊瑚自行組織蛋白質形成堅硬的骨骼 展現應對氣候變化的復原力
科學家的研究結果表明,珊瑚正在嘗試自主抵禦氣候變化。此前倡導進化論的英國自然學家查爾斯·達爾文注意到,珊瑚形成了影響深遠的結構,主要由石灰石製成,環繞著熱帶島嶼,但他不知道它們是如何完成這一舉動的。現在,羅格斯大學的科學家已經證明,珊瑚結構由一種生物礦物質組成,其中含有一種高度組織化的蛋白質有機混合物,類似於我們骨骼中的物質。
他們的研究發表在《英國皇家學會學報:界面》上,首次顯示出幾種蛋白質在空間上是有組織的,這一過程對於形成堅硬的珊瑚骨架至關重要。
Manjula P. Mummadisetti說:"我們的研究揭示了一個錯綜復雜的骨骼蛋白網絡,這些蛋白在空間上相互作用,這很可能適用於所有石珊瑚。"她在高級作者Paul G. Falkowski領導的羅格斯環境生物物理學和分子生態學實驗室擔任博士後助理時,領導了這項研究。她現在是賓夕法尼亞州波茨頓AVMBioMed的高級科學家。"了解珊瑚生物礦化的機制,以及這些無價的動物如何在人為氣候變化時代持續存在是很重要的。"
"我們的研究結果表明,基於珊瑚形成堅硬的岩石骨骼的令人印象深刻的過程的精確性、穩健性和彈性,珊瑚將經受住人類活動引起的氣候變化,"羅格斯大學-新不倫瑞克分校藝術與科學學院和環境與生物科學學院的傑出教授Falkowski說。
珊瑚礁保護了受到侵蝕和風暴威脅的海岸線,並為魚類提供棲息地、育苗地和產卵地。事實上,珊瑚礁為大約5億人提供了食物,他們也依靠珊瑚礁謀生。然而,氣候變化導致的海水變暖使珊瑚面臨致命的漂白和疾病風險。美國國家海洋和大氣管理局稱,更多的酸性海水、海平面上升、不可持續的捕魚、破壞珊瑚礁的船隻、入侵物種、海洋廢棄物和熱帶氣旋構成了額外的威脅。
羅格斯科學家研究了嵌入Stylophora pistillata骨架內的蛋白質的空間相互作用,Stylophora pistillata是印度洋-太平洋地區常見的石珊瑚。石珊瑚經過4億多年的進化,在亞熱帶和熱帶淺海形成了巨大的珊瑚礁。它們被稱為 "海洋雨林"。通過分泌碳酸鈣來建造珊瑚礁,這一過程被稱為生物礦化。
科學家們表明,幾種蛋白質共同作用,為生物礦化創造最佳條件。這些蛋白質並不是隨機分布的,而是在空間上有很好的組織,科學家首次詳細介紹了這些蛋白質和空間模式的共同作用,因為新的礦物質是在動物的活體組織和它的底部或舊的骨架之間形成的。
來源:cnBeta
蛋白質DNAJC 9可以釋放細胞內捕獲的組蛋白
在細胞核中,組蛋白起著至關重要的作用,將DNA包裝成染色質。組蛋白對DNA和RNA都非常粘著,因此為了確保它們在合成後被運送到細胞核,並與DNA的正確部分結合以組織染色質,它們被組蛋白伴侶的複合物所保護。
組蛋白伴侶蛋白是與組蛋白結合的蛋白質,幫助保護它們不受非特異性結合事件的影響,直到它們達到目標。這個過程有時會失敗,組蛋白在向染色質供應過程中被卡住,就不會起作用。研究人員已經證明蛋白DNAJC 9在保護組蛋白進而保護染色質方面有著重要的作用。
主動加入被動旁觀者
「到目前為止,研究人員一直認為組蛋白伴侶只能被動地保護組蛋白。我們發現DNAJC 9積極地參與了細胞蛋白質摺疊機制,這意味著它積極地吸收酶和分子伴侶為了重新部署被困的組蛋白。」負責這項研究的助理教授科林·哈蒙德(ColinHammond)說,哈蒙德是哥本哈根大學諾和諾德蛋白質研究中心(NovoNordisk Foundation Center For Protein Research)的成員。
組蛋白一旦從被捕獲的狀態釋放出來,就能重新與組蛋白伴侶(如MCM 2)接觸,並被組裝成核小體來組織染色質。當蛋白質DNAJC 9發生突變,失去吸收蛋白質摺疊機制的能力時,組蛋白就會被捕獲,從而丟失以獲得合適的染色質沉積。
科林·哈蒙德強調:「這意味著傳統的組蛋白伴侶不能完全保護組蛋白免受虛假相互作用的影響。相反,細胞依賴於分子伴侶和組蛋白伴侶的聯合作用,在它們的動態生命中保護這些至關重要的蛋白質。」
必要的強有力的協作
這項研究是建立在強有力的國際合作基礎上的。本文的第一作者是黃宏大實驗室的鮑紅玉(均為音譯)和中國南方科技大學的合作夥伴,以及斯隆·凱特琳癌症紀念中心的丁肖·帕特爾,他們提供了DNAJC 9的結構發現。這個功能分析由科林·哈蒙德領導,與CPR蛋白質組學項目的同事,伊沃·亨德里克斯和麥可·倫德·尼爾森密切合作,通過深入的蛋白質組學分析來剖析蛋白質的功能。
癌症研究的相關見解
DNAJC 9是許多癌細胞類型中癌細胞增殖必不可少的蛋白質,其水平與腫瘤細胞的表達率有關。與常規細胞相比,癌細胞中的染色質可能更依賴於DNAJC 9,如果是這樣的話,DNAJC 9可能成為未來癌症治療發展的目標。
科林·哈蒙德說:「雖然現在還為時尚早,但我們希望在我們對DNAJC 9生物學的理解上取得的這一基本進展有助於找到一種應對癌細胞活力至關重要的功能。」
更多內容:Molecular Cell (2021). DOI:
10.1016/j.molcel.2021.03.041
來源:kknews蛋白質DNAJC 9可以釋放細胞內捕獲的組蛋白
春天,外行人吃魚肉,內行人專吃它,蛋白質比魚肉高,長智又長個
「春天,外行人吃魚肉,內行人專吃它,蛋白質比魚肉高,長智又長個」。大家好,我是阿九,很高興和你們見面,今天分享的是蝦仁的吃法!喜歡阿九的美食分享,不妨動動手指點個關注吧。
春天生長黃金期,需要補充蛋白質,利用食物中的天然成分來補給,勝過各種保健品。很多人選擇吃魚蛋奶來補充,其實這就很外行,補充蛋白質內行人都專吃「它」,蛋白質比魚肉高,是魚肉、雞蛋、牛奶的幾倍甚至十幾倍,春天吃魚、蛋、奶不如吃它,它就是蝦仁,我們今天菜品的主角就是它。
蝦仁富含蛋白質,其含量約占本身營養的20%,是蛋白質含量很高的食品,和魚肉比它所含有的人體必需胺基酸纈氨酸並不高,但卻是營養均衡的蛋白質來源,還能補充鈣元素,老少皆宜營養豐富,尤其對小兒、孕婦有著非常不錯的補益功效。低脂含量低,美味又滋補,春季生長季節可多吃,不用擔心長膘哦,一周兩次幫助我們提升免疫強體質,小孩子常吃長智又長個,來學一道美味的蝦仁做法吧,好吃好看保准你們吃過一次會愛上。
-----【什錦蝦仁/蝦仁炒三丁】-----
【材料】大蝦仁半碗,青瓜、玉米、胡蘿蔔丁各少許,洋蔥粒蒜末適量,油鹽適量,黑椒汁適量
【製作】
1、大蝦剝殼去蝦線,清洗乾淨瀝乾水,放入碗里加適量黑椒汁調味。
2、青瓜胡蘿蔔去皮洗凈切小丁,玉米洗凈剝成小顆粒備用,洋蔥和大蒜切粒備用。
3、炒鍋預熱加多點底油,下入胡蘿蔔和玉米粒中火翻炒1分鐘,瀝油盛出來備用。
4、把鍋里的余油燒熱,放入蝦仁均勻炒散開,讓蝦仁吸收油的香氣變得更鮮甜。
5、蝦仁斷生以後加入洋蔥粒、蒜末、青瓜丁和胡蘿蔔、玉米粒炒香,加一點點鹽調味。
6、翻炒至充分入味就可以,這樣一道鮮美下飯的「什錦蝦仁/蝦仁炒三丁」就做好了。
春天,外行人吃魚肉,內行人專吃它,蛋白質比魚肉高,長智又長個~蝦仁這道吃法你學會了嗎?
-----【烹飪小知識】-----
1、蝦仁一定要去掉蝦線,這樣才會吃著少腥味,而且吃不到沙子,口感更加鮮嫩和Q彈。
2、蝦仁底味主要用到黑椒汁、以及炒過玉米胡蘿蔔的香油味調製,吃起來非常鮮香有味。
3、青瓜不耐炒,儘量生脆一點的口感才好,等到往後一點再下鍋不遲,做出來色香味俱全。
圖文原創,抄襲必究!我是@阿九的菜,如果您喜歡我的分享,請幫忙點讚收藏加轉發,有什麼建議和看法可以在文章下面給我留言,關注@阿九的菜,與你分享三餐佳肴,期待一起交流學習取得進步!
來源:kknews春天,外行人吃魚肉,內行人專吃它,蛋白質比魚肉高,長智又長個
研究發現可能導致新的抑鬱症治療的基因和相應的蛋白質
亞特蘭大退伍軍人事務醫學中心和附近的埃默里大學的研究人員利用一種創新的基於蛋白質的方法,發現了可能為新的抑鬱症治療方法指明方向的基因和相應的蛋白質。研究人員利用將全基因組關聯研究(GWAS)數據與人腦蛋白質組和基因數據整合在一起的全蛋白質組關聯研究(PWAS),發現了19個可能通過改變大腦蛋白質水平而導致抑鬱症的基因。他們還精確地指出了25種這樣的蛋白質,這些蛋白質有望成為新的抑鬱症治療的潛在目標。
研究人員在2021年4月的《自然神經科學》雜誌上詳細介紹了他們的方法和發現。
抑鬱症是一種常見病,但目前的治療方法對許多精神疾病患者無效。首席研究員Aliza Wingo博士表示,這項研究為尋找治療疾病的新藥物奠定了基礎,通過識別可能有助於抑鬱症病因的重要基因-蛋白質對,可以作為未來研究的有前途的目標。她也是埃默里大學的副教授。
在尋求新療法的過程中,研究小組在美國國立衛生研究院的支持下,旨在確定可能導致抑鬱症的大腦蛋白質。該團隊假設,遺傳變異通過改變某些腦蛋白的水平來影響抑鬱症。
研究人員Thomas Wingo解釋說,GWAS在研究中發揮了關鍵作用,但本身並不充分。GWAS是一個重要的工具,因為它能夠發現與醫療條件相關的變異,包括抑鬱症,但基因組掃描並不能闡明遺傳變異如何轉化為疾病風險增加。因此,研究設計將GWAS和人腦蛋白質組學數據結合起來,朝著回答問題的方向發展,大腦蛋白質水平的變化如何解釋抑鬱症的一些遺傳風險。
蛋白質是基因表達的最終產物,也是細胞的主要功能成分。通過研究蛋白質,PWAS可以幫助闡明抑鬱症的生物學機制。該方法可以通過發現正常基因中蛋白質的表達方式與變異基因的表達方式的變化,對GWAS的信息進行重要補充。盡管蛋白質作為「生物信息員」很有前景,蛋白質占藥物靶點和生物標志物的大部分,但這項研究在抑鬱症研究中很顯眼,因為它直接觀察蛋白質。
根據作者的說法,正是這種罕見的科學方法--使用 "最大最深的參考人腦蛋白質組和抑鬱症最新GWAS的匯總統計"--讓研究者們確定了總共25個感興趣的蛋白質,其中20個之前的GWAS研究並沒有將其歸為與抑鬱症有關。
至於他們歸位的19個基因,研究人員確定它們「通過調節其腦蛋白豐度,有助於抑鬱症的發病」。 Aliza Wingo說,通過聯合GWAS和人腦蛋白質組數據檢測到的腦蛋白波動很可能是抑鬱症中較早的生物學變化之一,並可能使人容易患病,因此該發現在治療潛力方面特別引人注目。
研究作者說,後續研究,包括模型系統中的測試,對於進一步研究已確定的基因在抑鬱症中的可能作用,並尋找更多受牽連的基因和蛋白質至關重要。受牽連的蛋白質似乎有助於抑鬱症的遺傳風險,這一建議刺激了Wingos實驗室正在進行的工作。
「我們非常高興能夠繼續在我們的實驗室中研究這些有希望的目標,但要提醒的是,通往新藥的道路是漫長而艱難的,」Thomas Wingo說,並指出了基於這一研究領域的另一個臨床希望。「我們心知肚明,這些發現也可以證明作為抑鬱症狀的生物標志物是有用的。一個有效的生物標志物--就像糖尿病的血紅蛋白A1C一樣--可以幫助診斷和管理抑鬱症。」
來源:cnBeta
研究稱「蛋白質浴」有助於器官「再細胞化」 使移植更安全
據外媒報道,雖然器官移植手術可以挽救生命,但如果接受者的免疫系統排斥外來細胞,就會出現並發症。一種新興的技術通過將供體細胞從供體器官中剝離出來,並將其替換為受體自身的細胞來降低這種風險,現在一項新的研究增加了一個額外的步驟,使這一過程更加有效。
成功的器官移植有許多障礙。首先是可能需要漫長的等待,尋找具有相同血型、相似體型以及其他因素(如距離和可用性)的捐贈者。即使找到了匹配的器官,也往往會出現排斥反應,患者需要服用抑制免疫系統的藥物,排斥反應可能使他們容易受到感染和其他疾病的影響。
但近年來,科學家們已經開發出一種可能繞過這一問題的方法。將器官浸泡在一種特殊設計的液體中,剝離出捐贈者的細胞,只留下細胞外基質--賦予器官形狀的支撐結構。在這種「去細胞化」之後,器官可以用從受體身上提取的細胞進行 "再細胞化"。這可以防止排斥反應,因為病人的免疫系統不會將器官識別為外來器官。
雖然理論上聽起來不錯,但不幸的是,仍有並發症。「去細胞化」過程會破壞細胞外基質,使新細胞更難附着在結構上並繁殖。改善這方面的問題是巴西聖保羅大學生物科學研究所(IB-USP)人類基因組和干細胞研究中心(HUG-CELL)的科學家們新研究的重點。
為此,研究人員在「去細胞化」和「再細胞化」之間增加了一個額外的步驟。在對大鼠肝臟的測試中,研究小組用含有SPARC和TGFB1等蛋白質的條件培養基清洗脫細胞器官,這些蛋白質是由肝細胞產生的,有助於它們增殖和生長血管。
然後在新調理的大鼠肝臟中加入一系列的人體細胞--肝細胞(主要的肝臟細胞)、內皮細胞(形成內膜的細胞)和間質細胞(干細胞的一種)。這些肝臟在培養箱中生長了五周。研究小組發現,被新溶液富集的肝臟比沒有該額外步驟的對照肝臟生長的再細胞化效果要好得多。
"用這些分子富集細胞外基質讓它變得更類似於健康肝臟的基質,"該研究的第一作者Luiz Carlos de Caires-Júnior說。"這種治療使肝細胞生長和功能更加旺盛。"
下一步,該團隊計劃建立一個更大的生物反應器,可以使人類肝臟去細胞化和再細胞化。這項技術應該也能在其他器官上發揮作用。
如果成功的話,這項技術可以在幾個方面擴大可供移植的器官庫。它將減少匹配捐贈者和接受者的需求,並可用於修復那些原本會受損或不健康而無法進行移植的器官。
該研究發表在《Materials Science and Engineering: C》雜誌上。
來源:cnBeta
科學家找到了從釀酒廢糧中提取蛋白質和纖維的新方法
無論是家庭釀酒愛好者還是大型製造商,在啤酒釀造過程中必然會產生堆積如山的剩餘穀物。一旦從大麥和其他穀物中提取了所有的味道,剩下的就是富含蛋白質和纖維的粉末,通常被用於牛飼料或被填埋。今天,科學家報告了一種從釀酒廢糧中提取蛋白質和纖維的新方法,並將其用於製造新型蛋白質來源、生物燃料等。
Credit: joshuarainey / Depositphotos
今天在美國化學學會(ACS)春季會議上,研究人員展示了他們的最新研究成果。該項目首席研究員 Haibo Huang 教授表示:「釀酒行業亟需減少浪費」。他的團隊和當地啤酒廠合作,尋找一種將剩餘糧食轉化為增值產品的方法。
同樣參與本次項目的研究生 Yanhong He 表示:「與其他農業廢棄物相比,廢舊糧食的蛋白質比例非常高,所以我們的目標是找到一種新的方法來提取和利用它」。在美國,手工釀造比以往任何時候都更受歡迎,這種需求的增加導致了產量的增加,產生了啤酒廠的廢舊材料,其中 85% 是廢舊穀物。這種副產品包括高達 30% 的蛋白質和高達 70% 的纖維,雖然奶牛和其他動物可能能夠消化廢穀物,但由於其纖維含量高,人類很難消化。
為了將這些廢棄物轉化為更有實用價值的東西,Huang和He開發了一種新型的濕法研磨分餾工藝,將蛋白質和纖維分離出來。與其他技術相比,新工藝的效率更高,因為研究人員不必先將穀物乾燥。
他們在這個過程中測試了三種市售的酶--鹼性酶、中性酶和胃蛋白酶,發現鹼性酶處理能提供最好的分離效果,而不會損失大量的任何一種成分。經過篩分步驟後,得到的是濃縮蛋白和富含纖維的產品。
廢糧中高達 83% 的蛋白質在蛋白質濃縮物中被重新捕獲。最初,研究人員提出將提取的蛋白質作為一種更便宜、更可持續的魚粉替代品來餵養養殖蝦。但最近,Huang和He開始探索將蛋白質作為食品中的一種成分,迎合消費者對替代蛋白質來源的需求。
下一步,該團隊計劃致力於擴大分離蛋白質和纖維成分的過程,以跟上啤酒廠產生的廢糧量。他們還在與同事合作,確定分離過程的經濟可行性,因為目前用於分離蛋白質和纖維成分的酶很昂貴。Huang和He希望找到合適的酶和綠色化學品,使這個過程更加可持續、可擴展和經濟實惠。
來源:cnBeta
瑞典查爾姆斯理工大學研究人員利用人工智能生成合成蛋白質
瑞典查爾姆斯理工大學的研究人員介紹了一種利用人工智能生成合成蛋白質的方法。這種新方法對於開發高效的工業酶以及抗體和疫苗等新型蛋白質藥物有着巨大的潛力。由於瑞典查爾姆斯理工大學的研究人員最近發表的工作,人工智能現在已經能夠生成新穎的、具有功能活性的蛋白質。 研究人員現在能夠證明的東西,為未來的一些應用提供了夢幻般的潛力,例如更快、更有成本效益地開發基於蛋白質的藥物。
蛋白質是大型、復雜的分子,在所有活細胞中發揮着至關重要的作用,在我們的細胞內自然構建、修飾和分解其他分子。它們也被廣泛應用於工業過程和產品,以及我們的日常生活中。以蛋白質為基礎的藥物非常常見,糖尿病藥物胰島素是最常用的處方藥之一。一些最昂貴和最有效的癌症藥物也是基於蛋白質的,以及目前用於治療COVID-19的抗體配方。
目前用於蛋白質工程的方法依賴於引入蛋白質序列的隨機突變。然而,每引入一個額外的隨機突變,蛋白質的活性就會下降。因此,人們必須進行多輪非常昂貴和耗時的實驗,篩選數以百萬計的變體,才能設計出最終與自然界中發現的蛋白質和酶有顯著區別的蛋白質和酶。
這個工程過程非常緩慢,但現在研究人員有了一種基於人工智能的方法,研究人員可以在短短幾周內從計算機設計拿到可以工作的蛋白。他們的新成果最近發表在《自然機器智能》雜誌上,代表了合成蛋白質領域的突破。研究小組和合作者開發了一種基於人工智能的方法,名為ProteinGAN,它使用了一種生成式深度學習方法。
從本質上講,人工智能獲得了大量來自研究良好的蛋白質數據,它研究這些數據,並試圖基於這些數據創造新的蛋白質。同時,人工智能的另一部分則試圖弄清楚合成的蛋白質是否是假的。蛋白質在系統中來回發送,直到人工智能無法再分辨天然和合成蛋白質。這種方法以創建不存在的人的照片和視頻而聞名,但在這項研究中,它被用於生產高度多樣化的蛋白質變體,這些變體具有類似自然主義的物理特性,可以測試其功能。
日常產品中廣泛使用的蛋白質並不總是完全天然的,而是通過合成生物學和蛋白質工程技術製成的。利用這些技術,對原有的蛋白質序列進行修改,希望創造出更有效、更穩定、針對特定應用的合成新型蛋白質變體。基於人工智能的新方法對於開發高效的工業酶以及基於蛋白質的新療法(如抗體和疫苗)具有重要意義。
來源:cnBeta
靶向光敏感蛋白質和分子的深度腦電刺激可預防小鼠模型中的癲癇發作
據外媒報道,科學家們希望為折磨大腦的病症提供更精確、更有效的治療方法之一是利用光來靶向細胞,通過對光敏感的蛋白質和分子,可以使細胞對這種刺激作出反應。弗萊堡大學的一個研究小組已經證明了這種技術可能如何解決癲癇問題,通過使用這種方法來防止小鼠疾病模型的發作。 ...
一種新蛋白質的發現有望帶來強大的肌肉再生新療法
雖然肌肉乾細胞能夠在我們受傷後生長並修復撕裂的肌肉組織,但隨着年齡的增長,它們的作用會減弱。現在,莫納什大學澳大利亞再生醫學研究所的研究人員發現了一種新型蛋白質,它可以觸發這些干細胞的增殖,促進癒合,不僅為那些肌肉撕裂的人提供了希望,也為老年人和患有嚴重肌肉萎縮疾病的人帶來了曙光。 ...
「Science」人工蛋白質成功修復神經連接,改善記憶,有望治療神經退行性疾病
本文為轉化醫學網原創,轉載請註明出處
作者:Cathy
導言:神經退行性疾病 (Neurodegenerative disease) ,以特異性神經元的大量丟失為主要特徵,是一類進行性發展的致殘,嚴重可致死的複雜疾病,如阿爾茨海默氏症、小腦性共濟失調等。多年來,由於腦功能的複雜性,這類疾病的治療一直是個難題。近日有研究人員開發了一種人工蛋白,並成功減輕了某些神經損傷和疾病的症狀,為這類疾病的治療帶來了希望。
突觸是神經迴路中的基本結構和功能單元,它們決定了神經元之間的連通性並提供了交流的途徑。在分子水平上,突觸是高度動態的,它們的重塑對於腦生理的各個方面都是必不可少的。人腦在龐大的神經元網絡中包含數萬億個突觸。突觸重塑對於確保有效接收和整合外部刺激以及存儲和檢索信息至關重要。
對此,來自德國神經退行性疾病中心(DZNE),英國和日本的研究人員開發了一種具有神經功能的蛋白質,研究表明,該人工蛋白質減輕了某些神經損傷和疾病的症狀,而在微觀水平上,重建突觸連接,建立並修復神經元之間的聯繫。
該研究於8月28日發表在頂尖學術期刊《Science》雜誌上。題為「A synthetic synaptic organizer protein restores glutamatergic neuronal circuits」
人腦的神經元網絡會經歷終生變化,以便能夠收集信息並以合適的方式存儲信息。這尤其適用於記憶的產生和記憶。突觸在大腦的適應能力中起著核心作用。它們是神經信號從一個細胞傳遞到另一個細胞的連接點。許多被稱為突觸組織蛋白的特異性分子確保了突觸的形成和重組。
人工蛋白質
該研究小組利用這種自然發生的分子的結構元素合成了一種叫做CPTX的人工蛋白質,並在疾病模型中測試了它的效果。並將該化合物施用給神經功能缺陷與人類相似的老鼠。具體來說,這些測試集中在阿爾茨海默氏症、脊髓損傷和小腦共濟失調——一種主要以肌肉協調失調為特徵的疾病。所有這些情況都與突觸的損壞或丟失有關。這項研究是幾個研究機構的專家共同努力的結果,包括DZNE的Magdeburg基地、英國MRC分子生物學實驗室、東京慶應大學醫學院以及日本愛知醫科大學。
合成突觸組織器CPTX的結構指導設計和應用
減輕疾病症狀
DZNE的高級研究員Alexander Dityatev教授說:「在我們的實驗室中,我們研究了CPTX對表現出某些阿爾茨海默氏病症狀的小鼠的作用。我們發現CPTX的使用可以提高小鼠的記憶力。」
研究人員還觀察到在阿爾茨海默病和所研究的動物模型中幾個重要的神經元參數恢復正常。也就是說,CPTX增加了突觸的變化能力,這被認為是與記憶形成相關的細胞過程。此外,還證明CPTX可以提高所謂的「興奮傳遞」。這表明,該蛋白質對促進接觸細胞活性的突觸具有特異性作用。最後,CPTX增加了樹突的密度。這些是細胞膜上的微小凸起,對於建立興奮性突觸連接至關重要。
進一步研究表明,將CPTX應用於運動功能障礙的小鼠(由脊髓損傷或類似於小腦共濟失調的病理狀況引起)可提高齧齒動物的活動能力。在細胞水平上,該蛋白被證明可以修復和促進興奮性突觸連接。
分子連接器
CPTX以獨特的方式結合了天然突觸組織蛋白中存在的功能域。該化合物被設計為神經細胞之間的興奮性連接的通用橋樑建設者。在兩個神經元相遇的地方,無論是粘著的接觸還是實際上的突觸連接,CPTX都連結到兩個相關細胞表面上的特定分子,從而觸發新突觸的形成或增強已經存在的突觸。
Dityatev強調說:「目前,該藥物處於實驗階段,其合成要求很高,因此我們離人類的應用還很遠。但是,我們的研究表明,CPTX在建立和加強神經連接方面甚至可以比某些天然類似物做得更好。因此,CPTX可以成為具有臨床潛力的新型藥物的原型。」 它將應用於與神經元連接受損相關的疾病。
「目前針對神經退行性疾病的許多治療工作都集中在阻止疾病進展,而恢復喪失的認知能力的前景微乎其微。我們的方法可以幫助改變這一情況,並可能開發真正恢復神經功能的治療。因此,在設計CPTX時,我們打算開發更多的化合物。在未來的研究中,我們希望改善其性能並探索可能的治療應用。」
參考:
【1】https://medicalxpress.com/news/2020-08-tailor-made-molecule-ties-nerve.html
【2】https://science.sciencemag.org/content/369/6507/eabb4853
來源:kknews「Science」人工蛋白質成功修復神經連接,改善記憶,有望治療神經退行性疾病
蛋白質折疊項目算力達240億億次 超越全球500台最強超算總和
分布式計算鼻祖、搜尋地外文明的SET@home功成身退,而作為當今規模最大的分布式計算項目,致力於研究蛋白質折疊、誤折、聚合及由此引起的相關疾病Folding@home徹底火了,特別是在加入對新冠病毒的研究、NVIDIA公開號召PC玩家參與之後,算力更是急劇增長。
在此之前,Folding@home的日常算力只有10億億次左右,而隨着更多用戶投身其中,項目算力很快就突破了100億億次,相當於世界第一超級計算機IBM Summit的大約7倍,也是全球最強103台超算的總和。
IBM Summit
根據最新統計,Folding@home項目現在的算力已經突破240億億次!
這是什麼概念?已經相當於17台世界最強超算IBM Summit,更超過了全球排名前500位超算的總和!
硬件方面,無論是AMD、NVIDIA顯卡還是AMD、Intel處理器,參與的數量都在大幅度增加,現在已有超過12萬顆AMD GPU、54.6萬顆NVIDIA GPU、157萬顆CPU(1134萬個核心)在貢獻自己的力量。
其中有你的一份嗎?
作者:上方文Q來源:快科技
蛋白質折疊項目算力超100億億次 N卡數量4.5倍於A卡
Folding@home是一個研究蛋白質折疊、誤折、聚合及由此引起的相關疾病的分布式計算項目,2000年10月1日啟動,目前已是世界上最大的分布式計算項目,並獲得了吉尼斯認可,今年2月27日加入新冠病毒研究。
NVIDIA日前也號召PC玩家加入Folding@home,為對抗病毒貢獻自己的算力,結果一呼百應,項目算力很快從10億億次暴漲到了超過100億億次,相當於世界第一超級計算機最大算力的大約7倍,是全球最強103台超算的綜合,更是當今高端桌面PC的大約100萬倍。
那麼,NVIDIA顯卡玩家到底參與度如何呢?AMD顯卡呢?
Folding@home其實對於參與計算的硬件有專門統計,過往50天內回傳有效計算單元的都會被記錄。
最新數據顯示,目前共有356065顆NVIDIA GPU在參與Folding@home,其中Windows 314952顆、Linux 41113顆,而參與計算的AMD GPU數量為79498顆,其中Windows 75823顆、Linux 3675顆。
也就是說,NVIDIA GPU的數量相當於AMD GPU的足足4.5倍,官方號召果然很有魅力。
另外,參與項目的CPU處理器共有593983顆,處理器核心共4630510個,平均每顆處理器7.5個核心。
作者:上方文Q來源:快科技