說在前面:下半年咕的厲害是因為被趕回去肝碩士畢業論文和康復治療師考試了,終於在過年之前兩個事情都搞定,可以又抽出時間摸魚更新科普文了~至於黑樓系列文章也會繼續逐步完成星盟和先行者的武器簡介,之後就要看《光環:無限》的具體表現了。但是現在只有兩個遊戲我最喜歡,第一個叫HEMA,第二個叫健身環!所以今天我們來談一談人類從事最長時間的遊戲:運動,以及它在我們康復治療和疼痛管理中的重要角色!
前言
對於廣大的玩家朋友們來說,疼痛一定是一個十分熟悉且人見人恨的超級怪獸,這種伴隨著人類成長生活的糟糕情緒總能挑到最不恰當的時間,把我們打的落花流水,抱頭鼠竄,而幾乎在每一個人的記憶深處,都會有那麼幾次永遠都無法忘懷的疼痛體驗,表明出人類面對疼痛這一終極難題的束手無策。因此,如何面對並戰勝疼痛,就成了人們自打出生以來就要進行的挑戰——無論是面對疾病和災禍的倒霉患者,還是在長時間的工作學習後依舊想要努力遊戲的你,都會在疼痛來襲的時候放棄一切抵抗躺平挨打,挨打之後繼續堅持反抗。
而每個人受到疼痛毒打的方式也不太一樣,疼痛和打遊戲一樣也分快慢,如果說急性的,短時間的疼痛就像是《黑暗之魂》中的初見Boss,開幕雷擊之後,就能被掌握方法的玩家克服挺過,那麼折磨動輒3個月起步的慢性疼痛,就是毫無疑問的《血源》孤兒,哪怕看過100遍攻略教程,這個關卡你就是毫無勝算。所以在那些長期抗爭慢性疼痛的患者眼里,那些忍一忍就過去的,針扎刀砍的軟組織損傷根本對他們毫無參考意義,而現有臨床研究的重點,也幾乎一致將火力對准了真正的超級Boss:慢性疼痛
慢性疼痛一直以來都是醫務工作者面對相關患者進行疼痛教育的重中之重,國內外長期以來的臨床實踐和嚴格試驗都證明:疼痛教育的執行與否,將會直接影響患者疼痛的感受和治療結果。因此,無論是尚未經受慢性疼痛洗禮的菜鳥,還是長期與疼痛摔打滾爬的勇士,都建議認識並了解一下這位惡霸的真面目。一直以來,現代醫學都不斷地嘗試開發並賦予人類以對抗疼痛的有力武器,而其中最新開發的DLC武器系統,便是許多人都難以想像的運動療法!
本期文章將為大家帶來專業的疼痛教育和運動鎮痛相關的知識科普,解釋神經系統如何處理疼痛,運動又如何利用這些機制對抗慢性疼痛。希望這些內容能夠為生活中所遇到的疼痛情況提供一定參考,特別是遊戲遊玩和電腦辦公後面臨骨骼肌肉慢性疼痛的玩家們,了解正在折磨你的疼痛,拿起健身環打開switch,也許是又一個戰勝它們的最好方法。

下文常見名詞縮寫對照:(非全部)
1 疼痛戰爭的矛與盾
作為一種本質性的神經信號,疼痛反應真正的寄居之所永遠是錯綜復雜的中樞神經系統。當我們縫合破損的皮膚,接上折斷的骨骼,去除變異的組織之後,疼痛往往並不會如我們所願地與那些急性損傷一並煙消雲散。它們會退縮到脊髓、腦干和大腦繼續反擊並鑄造一把名為「中樞敏化「[1]的邪惡長矛,讓每一次輕柔的撫摸都變成鑽心的刺痛,將開心和愉悅從大腦中抽離出去,並蛻變成令人束手無策的終極惡魔:慢性疼痛。
不過作為一種數千萬年進化歷史的終極產物,人類高效而多變的神經系統早已為這種挑戰做好了准備,它賦予了我們使用鎮痛之盾的鑰匙——使用最簡單的手法按摩和運動刺激就能激活位於大腦皮層[2]、丘腦、腦干以及脊髓[3]各處的防禦炮塔,瞄準一波波不受控制的疼痛信號持續開火,讓我們的意識在收到必要疼痛的提醒之後,不再因為過量的疼痛折磨而瀕臨崩潰,這面存在於神經系統內部的強韌護盾,就是「疼痛下行調控系統「。[4]

在過去的千百年里,我們可能都是依賴著運動和按摩等簡單的方式,嘗試開啟神經系統的疼痛調控系統,在與慢性疼痛的對抗中持盾奮戰。但當現代以來不到百餘年的社會劇變以工業化的偉大方式解放人類生活之後,運動逐漸退出了日常的主角舞台,而疼痛也以久坐不動、慢性代謝疾病、神經病理損傷以及癌症等屬於工業和資訊時代的全新方式再次襲來。
對付工業化的疼痛必然有工業化的手段,生理學和生物化學的先驅者們找到了在神經系統中疼痛的藏匿之所,並利用環氧化酶抑制劑(非甾體類抗炎藥),阿片/大麻素受體激動劑(麻醉類鎮痛藥),血清素/去甲腎上腺素再攝取抑制劑(抗抑鬱藥物)等等一系列超級戰士[5]進行精確打擊。它們面對急性和劇烈的疼痛刺激表現出超乎想像的治療效果。

但是在慢性疼痛「中樞敏化「長矛的威脅之下,療效減弱甚至是成癮風險(僅限麻醉類鎮痛藥)就成為了這些藥物治療最大的問題。
此時,疼痛下行調控系統這面曾經的,屬於神經系統本身的超級大盾被再次搬了出來,我們將運動[6]、按摩[7]甚至是電/磁刺激[8]當成鑰匙並精確打磨它們,以圖再次啟動那些位於中樞內部的防禦炮塔,它們將輔助來自現代工業化的鎮痛藥物,面對疼痛戰爭的挑釁威脅一同吹響反攻的號角。
1.1 疼痛之矛:中樞敏化綜合征
在疼痛戰爭的戰場之上,人類面對跌打挫傷等短暫的急性疼痛已經取得了巨大的優勢,我們利用鎖定疼痛傳遞和致痛物質合成的藥物阻斷了它們的後路,並結合高超的外科手段修復任何可能滋生疼痛的組織損傷。但是,在一些神經系統自身受損的情況中,以及那些人們注意不到的隱秘角落里(例如在久坐不動時輕微的肌肉緊張等),一部分沒有被及時消滅的疼痛刺激開始潛入中樞神經系統,逐步滲透和破壞,並最終鑄就了一把威力巨大的邪惡長矛:中樞敏化。
在目前的疼痛神經科學視角下,中樞敏化被認為是慢性疼痛的罪魁禍首。來源於骨骼肌肉慢性損傷或神經系統損傷中未被消滅的、持續存在的疼痛刺激將不斷地刺激中樞感覺神經通路,並使得中樞神經系統產生痛覺敏感的可塑性變化。[9]一般而言,疼痛刺激需要通過3級感覺神經元的信號傳遞,經過脊髓背角、腦干以及丘腦之後才會最終抵達大腦皮層並形成疼痛感覺。而中樞敏化最早發生的區域就是脊髓背角1級(即背根神經節DRG)和2級感覺神經元進行突觸傳遞的位置,這里是疼痛戰爭的主戰場。

來自外周傷害感受器的疼痛信息需要通過DRG在脊髓背角這個區域的突觸向上繼續傳遞,正常的痛覺信息依賴P物質作為神經遞質,激活突觸後膜的對應受體以活化下一級神經元。但是,如果這種突觸傳遞過於頻繁且一直重復的話,那麼突觸後膜上的其他受體[10](例如NMDA,AMPK等)就會被異常激活,它們將通過一系列信號通路改變感覺神經元的功能,讓它過度興奮並放大向上傳遞的疼痛信號,甚至還會誘導各種炎性因子[11](BNDF,TNF-α,IL-6等等)的釋放來產生額外的炎症和疼痛刺激。
當這些被放大的,重復出現的疼痛信號抵達丘腦和大腦皮層時,也會在一段時間的刺激下改變這些結構內神經元的正常功能,讓它們對疼痛的抑制和調控能力減弱甚至是失效。最終,不斷重復的疼痛刺激將導致整個中樞神經系統的可塑性變化,表現為其對疼痛甚至是非疼痛的刺激產生過敏現象,大幅放大和強化疼痛信號。[9]

中樞敏化所需要的神經可塑性變化往往需要一段時間才能夠形成,而當其形成之後,即便我們解決了最初的組織損傷,神經的異常敏感性也不會恢復正常,而將繼續不斷地放大其實很小甚至是不存在的疼痛信號。這就是許多人難以理解的,和組織損傷並無關系的慢性疼痛現象,這種疼痛往往找不到明確的來源和位置,盡管強度不高但是會持續存在,甚至會進一步威脅我們的心理和生理狀態,產生焦慮、抑鬱和失眠的嚴重影響。[12]
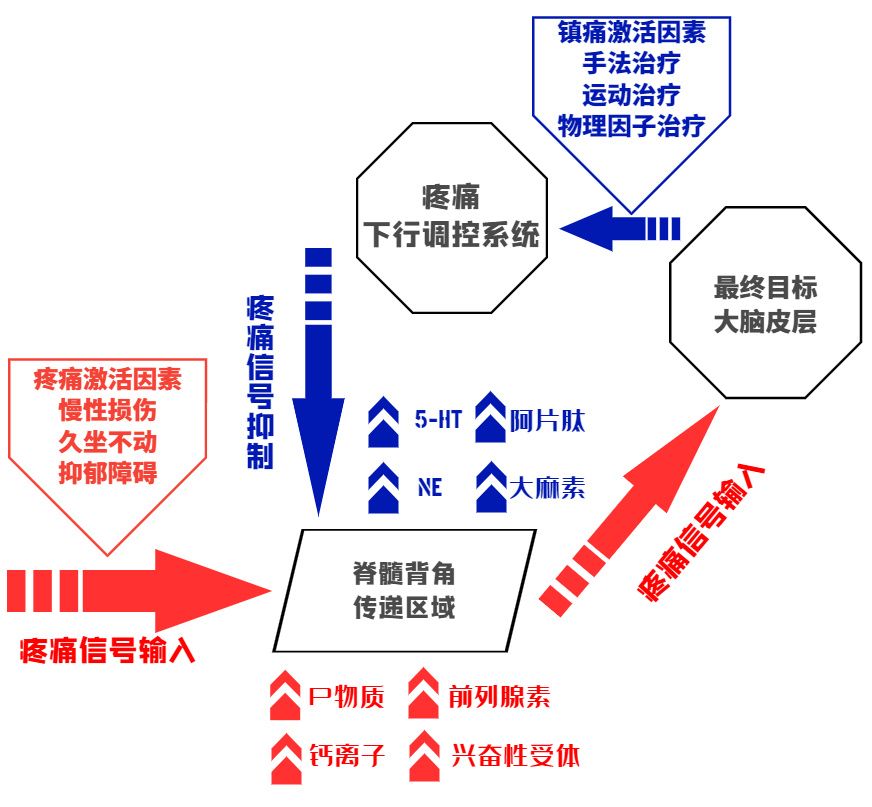
由於中樞敏化影響的區域遍及整個神經系統,其不僅僅會加速疼痛信號的傳遞,還會干擾那些本來負責抑制疼痛的神經元功能,降低中樞對疼痛信號的抑制能力[13],也大幅限制了鎮痛藥物的療效。比如慢性疼痛將會嚴重損耗中樞疼痛下行調控系統的彈藥:5-HT,NE以及GABA等,而這些彈藥的缺乏一方面會導致鎮痛能力的喪失,另一方面甚至會直接誘發病理性的抑鬱症(抑鬱症的一大問題就是中樞5-HT的嚴重不足)。因此,尋找簡便並有效的方式,嘗試修復並重新激活中樞的鎮痛系統將很可能是對抗慢性疼痛的主要手段。
1.2 守護之盾:疼痛下行調控系統
對於來自從脊髓、丘腦到皮層上行傳遞的疼痛信號,中樞神經系統存在一套結構來針對過量或過強的疼痛刺激進行調控。這套名為疼痛下行調控系統的超級護盾以丘腦作為指揮中心,它將接收來自大腦皮層相關區域(包括初級感覺皮層S1,初級運動皮層M1,前扣帶回ACC,杏仁核等)的指令、以及脊髓背角疼痛信息的傳入,並在整合和判斷後決定如何開啟對疼痛信號的調控干預。
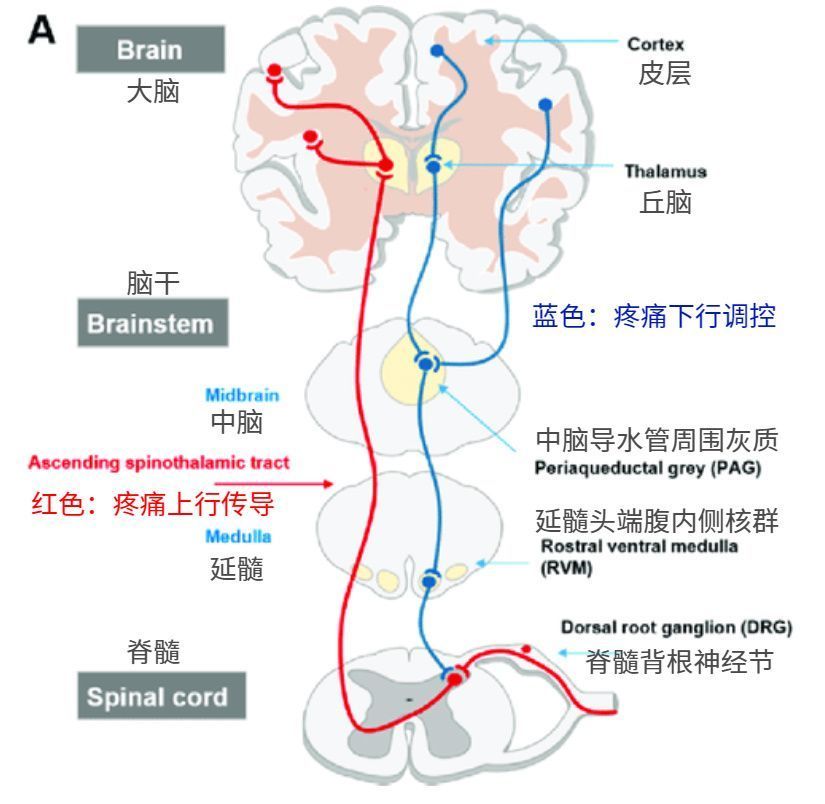
首先,疼痛刺激會根據強度和時間被判斷為過強或是過弱,接著丘腦將會通過一系列單胺能神經元以突觸釋放血清素/5-羥色胺(5-HT)[14,15]和去甲腎上腺素(NE)[16]等神經遞質的方式,直接或間接通過中腦導水管周圍灰質(PAG)的途徑,激活延髓頭端腹內側核群(RVM)內的功能神經元。其中RVM區域存在3種主要的神經元:OFF細胞負責抑制和關閉疼痛信號,ON細胞負責促進疼痛信號,Neutral細胞(即中性細胞)的功能則尚未可知。[17]
如果疼痛刺激需要被抑制,那麼接收來自丘腦和PAG指令的OFF細胞將會通過其直接投射到脊髓區域DRG的軸突突觸釋放5-HT/NE作為抑制性神經遞質,其可以阻斷和限制P物質的釋放和傳遞,進而減弱2級神經元向上的疼痛傳導。同時還可以直接激活位於脊髓背角的中間神經元,它能夠向突觸後膜釋放內源性阿片肽以直接阻斷疼痛傳遞。在多重因素的共同打擊之下,疼痛信號的傳遞就能夠被及時抑制,恢復我們的正常感覺。
而如果疼痛刺激需要被強化,或是由於中樞敏化等原因被迫強化,那麼RVM區域的ON細胞就會被激活,同樣通過干預脊髓背角突觸區域,活化NMDA等興奮性受體[10]來加強DRG感覺神經元的活動水平,從而強化疼痛信號的傳遞。[18]
很有趣的一點是,在生化研究發現其具體的神經遞質證據之前,我們是如何確定、或者說如何有目的地激活這一疼痛下行調控系統的功能呢?答案非常簡單,那就是被稱為「以痛鎮痛「模式的條件性疼痛調控(CPM)[13,19]效應。由於中樞神經系統需要對高強度的疼痛刺激進行識別後才能激活下行疼痛調控,因此,物理治療師或是臨床醫師將會使用手法或是其他物理因子作為【條件刺激】,對組織或肌肉中疼痛敏感度較高的區域(例如肌筋膜激痛點MTrP)施加短暫高強度的感覺刺激,從而誘導和啟動疼痛下行調控系統以降低全身的疼痛反應。
而作為條件刺激施加的按摩手法、物理因子療法甚至是運動刺激的強度和模式,就是目前物理治療臨床研究的重點之一。

對於健康且無痛的人群,進行CPM測試能夠引起全身顯著的鎮痛反應[20]:例如將手浸入0-4℃冰水並保持30s後,其腿部激痛點的疼痛感覺閾值會升高達25%以上;但是一個未經疼痛系統治療的慢性疼痛患者則無法引出這種效果,少部分中樞敏化嚴重的人群甚至出現了CPM效應的完全消失——這毫無疑問意味著疼痛下行調控系統幾乎完全宕機。[21]因此,除了對骨骼肌肉慢性疼痛進行持續的手法治療以求恢復其功能之外,目前在臨床上作為慢性疼痛一線藥物的抗抑鬱藥(包括TCAs,SSRI以及SNRI)就是以為PAG、RVM等區域補充鎮痛彈藥(即5-HT和NE等)的方式來對抗中樞敏化。
但是有沒有一種相比於藥物和手法治療更加簡便,規避風險且幾乎沒有缺點的干預方式呢?就目前研究的發現而言,這個答案很可能是:運動。
2 運動與慢性疼痛
人們其實對運動有著一種十分樸素而又准確的認知,那就是機核名言:「沒事別老宅在家里,多出去運動「。對於已經被現代生活壓榨的一滴不剩的打工人們,在工作和生活的間隙能夠出來走走玩玩已經是難得的奢侈,而想去參與那些強度和技術要求頗高的競技類運動項目更是百聞而不曾一試。但是拋開宣傳媒體和職業體育的精彩畫面,我們將如何定義運動呢?
如果結合遊戲的視角,在學術層面上,體育運動的定義出奇的廣闊而簡單:有目的性和規律性的,以【身體活動】作為主要交互手段的【遊戲】。目的性可以是勇爭冠軍(競技體育和競技遊戲),也可以是娛樂和健康(群眾體育、運動療法和休閒遊戲、嚴肅遊戲),而規律性則定義了身體活動的組織形式,其需要符合一定的動作、力量、位移以及時間的遊戲規則。因此,任何具有強度和動作要求的規律身體活動都可以被視作運動,而不同類型的運動自然會對身體產生不同的影響效果。

就像RPG遊戲的成長加點需要明確方向一樣,不同類型的體育運動所產生的效應大相逕庭。例如競技體育運動員們所從事的體育運動需要重復度極高的訓練、需要逼近生理極限的力量\速度或精準性等等,這類運動將會針對性大幅強化身體中的某個單一能力,但一定會以其他能力的失衡作為代價,產生遠超普通人群的受傷風險和消極影響。
而作為以快樂和健康為主要目的的群眾體育活動,我們往往會建議不要去盲目追求運動表現和體能素質,而是提高我們參與體育運動的時間和頻率,豐富參與體育運動的種類和方式,把運動當成需要天天玩的遊戲一直開心的玩下去,同時幫助我們改善身體素質,提高心肺和肌肉耐力以對抗各類慢性疾病和衰老風險。而和許多人所想像的完全相反的是,只是規律性地參與中低強度運動所帶來的收益,將會遠遠超過高強度競技運動。在某種程度上而言,許多疾病只需要「動起來「,不管是跑步騎車還是健身環都足夠有效,然而一旦運動強度超出閾值,運動相關的損傷和其他疾病風險反而會迅速升高。

兩種運動截然不同的結果,部分基於其對我們中樞神經系統的影響之上。拋開運動刺激對骨骼肌肉的簡單影響,目前的研究[6]正在逐步揭示如下的規律:不同強度和類型的運動會和疼痛刺激類似,引起大腦皮層[22]、丘腦、腦干以及脊髓[3,23,24]相關神經元的可塑性變化:中低強度的輕松運動能夠發揮顯著的鎮痛效應,而高強度的疲勞性運動刺激將會助長中樞敏化,成為誘導甚至加重慢性疼痛的罪魁禍首。[6]
因而,當我們回到抗阻慢性疼痛的戰場,運動作為人類千年以來都未曾離去的親密夥伴,也許將會帶著那把一度被我們所忽視的鑰匙,開啟中樞神經系統的疼痛下行調控系統。
2.1 運動鎮痛效應
無論是生活實踐還是臨床治療,參與並堅持合適強度的體育運動一直以來都是對抗慢性疼痛的首選之一,而究竟多少強度的運動刺激能夠引發鎮痛效果或是誘發其他風險,以及它們是通過什麼方式影響中樞疼痛調控系統,則成為了物理治療師和科研工作者所一直探尋的根本問題。
運動誘發鎮痛效應(Exercise-Induced Hypoalgesia, EIH)[6]在健康無痛的普通人群中早已獲得廣泛的驗證和證據支持[25]:無論是全身運動還是局部抗阻運動、有氧運動或是無氧運動均能引起全身性的EIH效應。[26-28]引起明顯的EIH效應只需要低至中等水平的運動刺激,並且在一定范圍之內,鎮痛效應的水平隨著運動強度的上升而升高,但是超過一個閾值強度後,運動帶來的鎮痛效果將會迅速消失,取而代之的則是高強度疲勞性刺激帶來的運動致痛效應(Exercise-Induced Hyperalgesia, EIA)。[29]

但是在存在中樞敏化的慢性疼痛患者之中,EIH效應則出現了不同程度的下降甚至是失效,並且其和運動強度和位置的關系十分密切。[30]一般慢性疼痛患者相比常人,其需要進行更低強度的運動才能維持EIH並避免EIA效應的出現。[31]而如果是區域性的慢性疼痛,則需要以避開受累區域的運動方式[32,33]激活EIH效應:例如慢性肩痛的患者可以採取下肢抗阻訓練,而慢性膝痛的患者則可以選擇上肢抗阻練習。而出現此現象的原因,在很大程度上就與中樞敏化和疼痛下行調控系統相關。
對於一般人群,假設誘發EIH效應最低的強度為I1,誘發EIA效應最低的強度為I2,那麼I1<I2。低於I1的運動刺激對疼痛影響很小,而在I1-I2之間則為鎮痛效應和運動強度的正比關系,一旦超過I2,運動刺激將會出現疼痛反應,最終惡化疼痛反應甚至出現中樞敏化。對於慢性疼痛患者而言,其I1強度可能不會有太大變化,但是I2強度將會明顯下降,因此慢性疼痛患者需要時刻控制運動強度以規避可能的風險。

對於疼痛下行調控系統而言,目前的研究已經發現了各類運動誘導EIH並改變相應神經系統功能的動物實驗證據,並進行了初步的機制推測。I1(較低強度)水平以上的運動刺激將會首先興奮位於大腦皮層的初級運動皮層(M1)和初級感覺皮層(S1),並進而興奮前扣帶回(ACC)和杏仁核等結構[22],這些最高級別的中樞將會增強丘腦疼痛下行調控系統的功能水平,增強PAG,RVM區域的5-HT[3]、NE以及內源性大麻素[34]等神經遞質表達(或是活化對應的受體功能,例如5-HT1A受體和大麻素CB1受體),強化疼痛調控的水平和鎮痛效果,使得受到中樞敏化的下行疼痛調控系統逐步恢復正常功能。
而對於接近I2級別(較高)的運動刺激,其除了會增強疼痛下行調控系統的功能之外,甚至還會以較強感覺刺激的方式直接啟動CPM效應[35],開啟「以痛鎮痛「的模式來觸發更加明顯的EIH效應。同時還有實驗證據發現,較高強度的運動可以激活體內阿片肽的釋放[36](以及活化阿片肽受體),產生內源性阿片肽的鎮痛效應,幫助阻斷疼痛信號在脊髓背角的傳輸過程,這一發現甚至在運動幫助戒除毒癮的研究中也有一定的應用。

盡管上述絕大部分的實驗證據都來源於動物模型,但是隨著醫學監測科技的不斷進步,使用功能性核磁共振(fMRI)[37]、經顱磁刺激(TMS)[8]等方式在人類模型上驗證EIH效應的腳步也在不斷加快,而臨床上也逐漸將運動處方和抗抑鬱藥聯合使用,開始了針對中樞敏化性慢性疼痛的治療嘗試。同時,運動鎮痛效應的研究也推動了運動干預抑鬱症的臨床實踐,並使其成為了後者最為常見和安全的干預方式,本文對此方面則不再贅述。
2.2 運動致痛效應
盡管合適強度范圍內的運動刺激能夠產生EIH效應,但是當強度繼續不斷增加,或是以較高強度連續運動時間過長的時候,這些疲勞性運動刺激將又一次變成揮之不去的可怖陰影,作為傷害性刺激信號連續作用於中樞神經系統,產生甚至助長慢痛患者本就十分嚴重的中樞敏化效應。
實際上,對於「以痛鎮痛「的CPM效應而言,其所施加的,引起疼痛抑制的高強度刺激也必然是短暫的,絕大部分的手法和物理因子治療都會嚴格控制強刺激施加的頻次和時間,其根本目的就是避免這種新的疼痛刺激,取代原有刺激再次連續影響中樞神經系統,產生中樞敏化的惡性反應。而體育運動導致EIA效應的本質也是如此,早在數十年前的研究[38]就驗證了疲勞性運動刺激所帶來的疼痛加重,而這種刺激和中樞敏化效應十分類似,其在RVM區域激活了大量的ON細胞和NMDA受體,強化了脊髓背角區域的痛覺傳遞。[18,39]

而對所有外界刺激都更加敏感的中樞敏化慢痛人群,其毫無疑問將會更容易受到過量運動所帶來的嚴重影響,一種對於常人合適的強度應用在疼痛患者中就成為了疲勞刺激。這也是許多曾經熱愛體育運動的慢痛患者,或是正在受到骨骼肌肉疼痛折磨的人們再次拒絕運動的可能原因,而對於難以掌握合適運動強度和運動方式的百姓大眾,選擇暫時的避免運動也是迫不得已的安全妥協。
2.3 使用運動對抗疼痛
在目前的實驗證據和臨床實踐的前提下,參與並長期進行規律性的中低強度運動將是產生EIH效應,利用中樞疼痛下行調控系統以對抗各類疼痛,抑制中樞敏化的可行方式。同時,由於這種中樞性的全身效應並不直接受到運動類型和區域的影響,因此人們依舊可以根據健身、娛樂或是規避受傷肢體的需求,自由靈活地進行盡可能豐富的體育運動,通過自身能夠堅持並樂在其中的方式保持持續的運動參與。

根據美國運動醫學學會長期以來多個版本的運動指南建議,健康人群保證每周150分鍾以上的,每天15-30分鍾的中等強度運動量依舊是十分必要的水準。對於運動強度而言,普通人群可以藉助佩戴心率計的方式進行簡單衡量:首先確定自己的最大心率HRmax(即220-年齡的數值),同時在安靜狀態下測量自己的靜息心率HRrest(即靜坐時計數10秒脈搏後乘6即可),使用HRmax減去HRrest就能得到儲備心率HRreserve,那麼:
如果考慮到鎮痛/抗抑鬱的需求,盡管目前沒有可作為參考的臨床指南結果,但是選擇略低於或者接近中等強度的水平是較為安全的范圍。而對於慢性疼痛患者而言,考慮到EIA效應在不同中樞敏化程度的患者上所體現的不同水平,直接一刀切地規定「合適強度「是十分不現實的舉措。因此,慢痛患者必須在物理治療師和臨床醫生的指導下,在自身感覺輕松的前提下選擇低強度的簡單活動,避免使用疼痛的關節或是肢體進行動作,將是繼續誘導EIH效應,以配合鎮痛藥物治療中樞敏化的可行方式。[25,40,41]

除此之外,在運動類型的選擇中,盡管在鎮痛/抗抑鬱方面沒有明確的限制,但是根據目前臨床慢性疾病運動治療的實踐經驗,我們依舊推薦人們經常參加2-3種或以上數量的不同運動。這些運動盡可能包括持續性的有氧運動,抗阻運動以及針對心肺耐力水平的全身運動。並在一周或數周之內不斷交替/同時進行。
實際上,作為運動類嚴肅遊戲典型的《健身環大冒險》基本囊括了上述所有的運動類型,我們玩家可以在遊戲中體驗抬腿運動(對應慢跑),各種全身徒手無負重的抗阻運動,以及利用健身環進行的局部抗阻運動。這些豐富的動作選擇和相當完整的RPG遊戲體驗將會為玩家堅持持續的運動參與提供充足的助力,也許在未來的某一時刻,這種類型的運動遊戲將會被納入康復臨床實踐之中,以非常友善且新穎的運動干預方式喚起慢痛患者們嘗試運動治療的信心,並結合之後的臨床研究證據,為患者提供最為安全、合適且有效的運動鎮痛體驗。

小結
疼痛反應是痛苦的,而與慢性疼痛的抗爭也將是十分漫長且艱巨的。所以,無論是患者還是健康人,每當多了解一些疾病背後的機制,就會多積攢一些抗爭病痛的信心。在閱讀本文之後,希望大家能夠知道:疼痛不等於你的身體組織一定出現了損傷,疼痛的強度和你損傷的嚴重程度不一定相關,而合理治療,保持勇敢以及自信將是戰勝它的最強武器。
需要說明的是,針對任何可能出現和面對的異常疼痛情況,請不要自行忍耐,並及時尋求正規的醫療幫助,特別是專業的【疼痛科】或【康復科】等相關科室,因為它們很可能是重要疾病或是病變的警告。請在接受正規的疼痛治療,疼痛管理,以及疼痛教育的時候充分信任你的醫生或是治療師,並且對治療和康復保持勇氣和信心。除特殊情況外,鎮痛治療永遠是疾病治療中的重點部分,請遵照醫囑接受鎮痛治療,參與治療性質的體育運動或服用鎮痛藥物,不要因試圖表現得堅強而拒絕鎮痛治療。
希望所有的玩家朋友能夠健康開心地享受遊戲生活,不會受到任何形式的疾患困擾;同時也祝願正在與疼痛抗爭的各位勇士,能夠戰勝病痛,早日康復!
擴展閱讀
疼痛神經科學科普:慢性疼痛
參考文獻
來源:機核